
Svar på opgave 1: Stevia - et naturligt sødemiddel
-
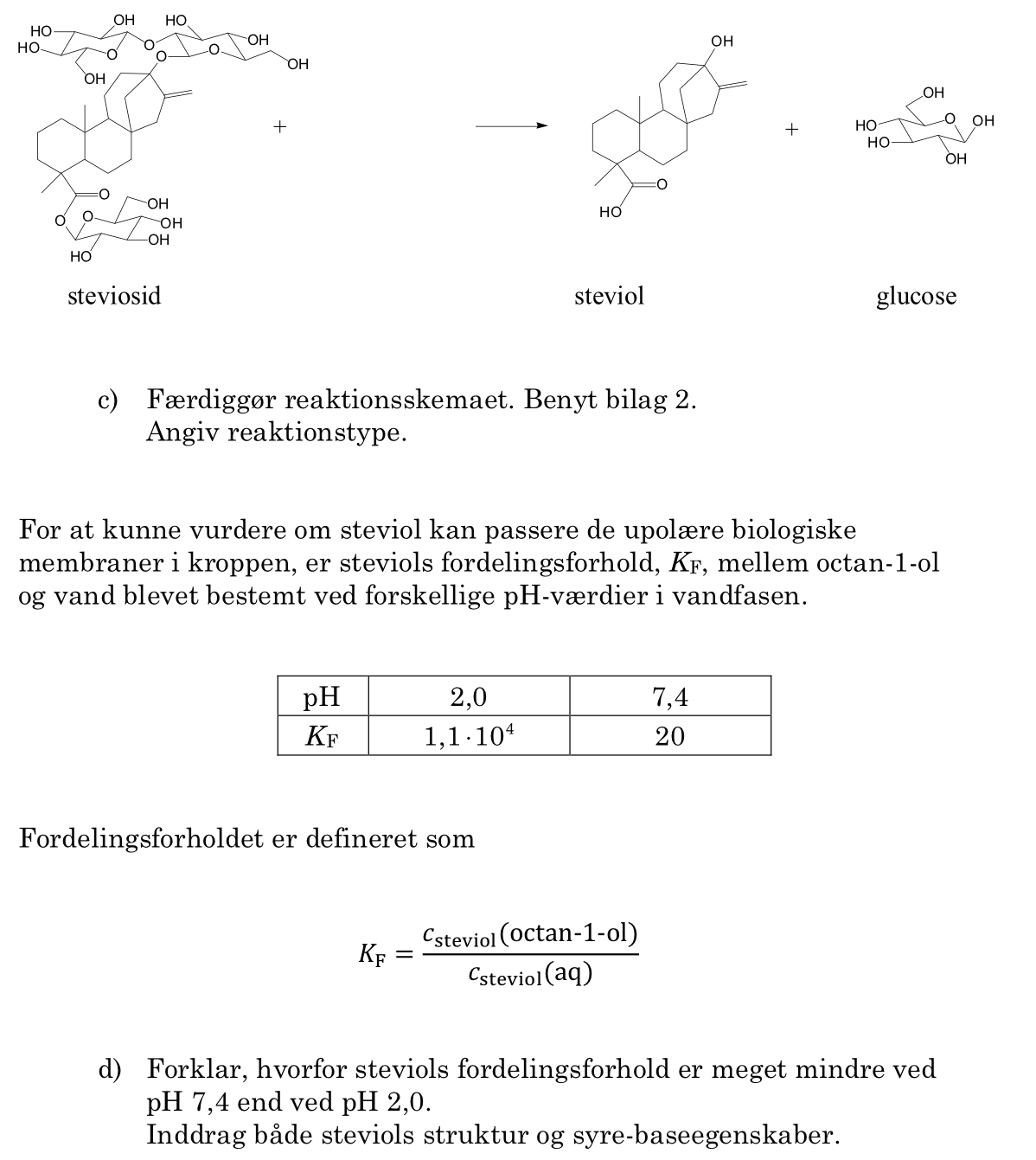
Nedenstående billede viser de funktionelle grupper i røde ringe.
-
Stoffet har 6 asymmetriske kulstofatomer, og kan dermed optræde i stereoisomere former.
-
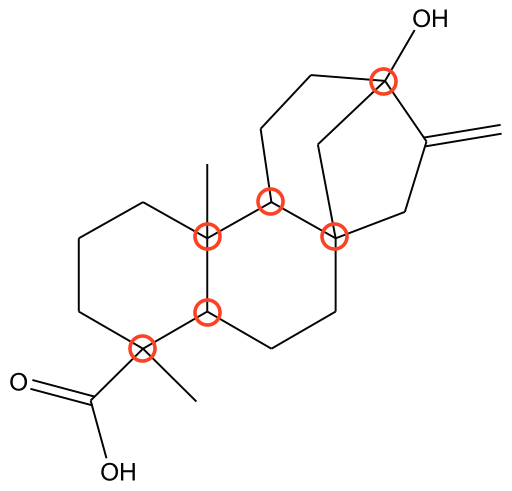
Der er tale om (enzymatisk) hydrolyse af tre glykosid-bindinger (vist med * på billedet nedenunder. Den nederste binding kan også kaldes en esterbinding).
-
Steviol har to hydrofile grupper: -OH og -COOH. Derudover har stoffet 20 kulstofatomer, dvs. 10 kulstofatomer for hver hydrofilgruppe. (Molekyleformel = C20H30O3)
Ved basiske forhold, dvs. høje pH-værdier vil carboxylsyren blive til den korresponderende base, som er en ion. Da ioner er sværtopløselige i en organisk fase (et organisk opløsningsmiddel) vil en større del af stoffet bevæge sig over i vandfasen og KF falder, fordi brøkens nævner bliver større samtidig med at tælleren bliver mindre.

Svar på opgave 2: Et cancerhæmmende stof i broccoli
-
Molmassen af sulforaphan = 177,29 g/mol. Massen af 0,05 mmol sulforaphan er derfor: (0,05 mmol)·(177,29 g/mol) = (0,05·10-3 mol)·(177,29 g/mol) = 0,0088645 g = 8,865 mg
-
At reaktionen er af første orden med hensyn til koncentrationen af sulforaphan betyder, at koncentrationen af suforaphan Cs kan skrives
Cs(t) = b·at, hvor a og b er konstanter og t er tiden i timer.
Konstanten b er lig med startkoncentrationen (20 μg), som her er lig med maksimumkoncentrationen. (Man behøver ikke b for at løse opgaven.)
Konstanten a kan bestemmes ud fra halveringskonstanten (T1/2), idet T1/2 = ln(1/2)/ln(a). Dette giver følgende ligning for a: 2,2 = ln(1/2)/ln(a) ⇒ a = eln(1/2)/2,2 = 0,72974.
Når Cs(t) er 10 % af maksimumkoncentrationen vil det sige, at Cs(t) = 0,1·b og dermed har man følgende ligning med hensyn til tiden: 0,1·b = b·0,72974t ⇒ 0,1 = 0,72974t ⇒ t = ln(0,1)/ln(0,7297) = 7,3082.
Dvs. der går 7,3 timer før koncentrationen af sulforaphan i blodet er nede på 10 % af maksimumværdien.
-
Kogning ødelægger ESP, det enzym der er ansvarlig for den uønskede sidereaktion: B → C.
-
Ved at dele peptidbindingerne (···CO – NH···) midt over kan man se, hvilke aminosyrer, som tripeptidet består af.
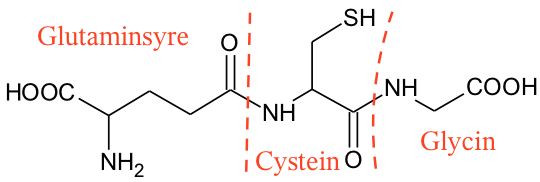
Det ses at være glutaminsyre, cystein og glycin.
-
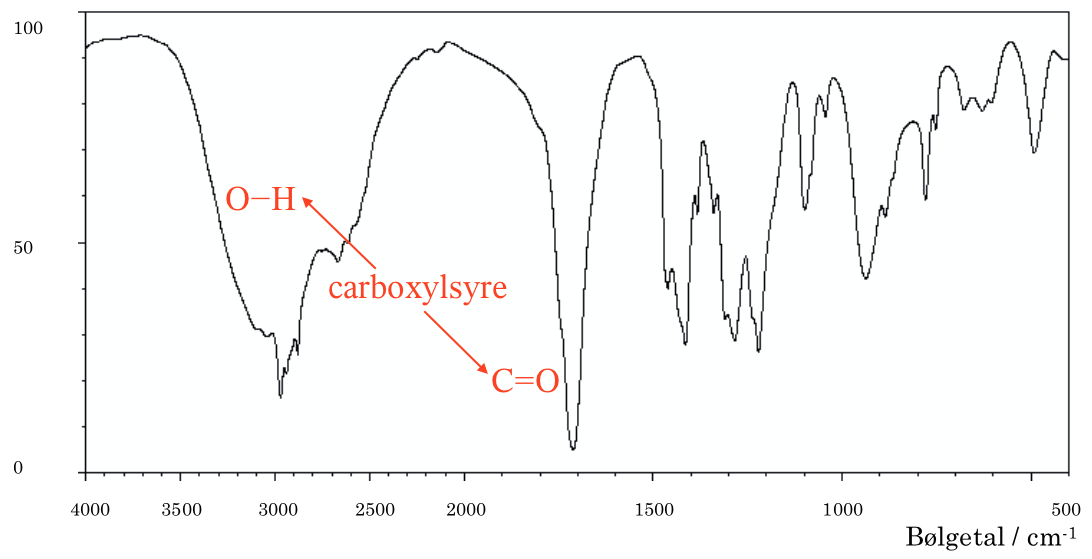
Det brede bånd yderst til venstre på IR spektret tyder på en O-H binding, mens det smalle lange bånd til højre for dette tyder på en C=0 dobbeltbinding. Som vist på billedet nedeunder tyder dette på en carboxylsyre-gruppe.
På NMR-spektret ser man først, at der er 8 H; det ses ud fra integralet, den røde kurve. Dernæst ser man på singletten yderst til venste (A på billedet nedenunder). Den ligger mellem 10 og 13 i skift og passer med -COOH. Det at det er en singlet passer med at H'et sidder på O'et og dermed ikke kobler med andre H.
Toppen yderst til højre (D) passer i skift med -CH3, der rummer det endestillede C-atom. Dermed er der redegjort for 4 H.
De to øvrige toppe har et skift, der ligger mellem 1,0 og 2,5. De har begge et integrale på 2, hvilket tyder på, at de begge er -CH2- grupper.
De to H-atomer, der giver sekstetten (C) må være omgivet af 5 H-atomer på de tilstødende C-atomer og dermed må (C) være forbundet til (D) på den ene side og (B) på den anden. (B) er en triplet og det C-atom, som H-atomerne sidder på må derfor være forbundet til (A) og (C), der til sammen har 2 H-atomer.
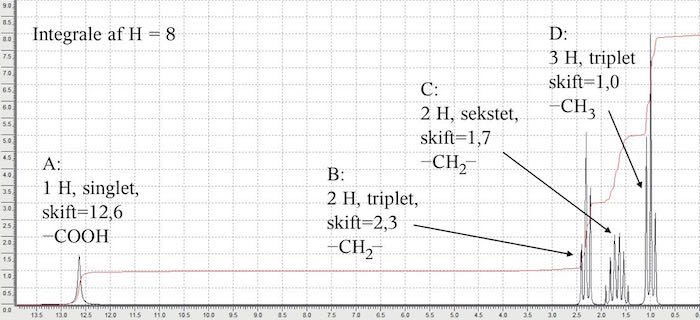
Stoffet er dermed CH3-CH2-CH2-COOH eller butansyre.

Svar på opgave 3: Ozon og iodforbindelser
-
Man finder pH ved hjælp af pufferligningen: pH = pKs(H2PO3-) + log([HPO32-]/[H2PO3-]) = 7,21 + log(0,086 M/0,014 M) = 7,21 + 0,788 = 8,00
-
Man slår ΔGo op for de øvrige stoffer i reaktionen:
ΔGo(I-) = -51,6 kJ/mol
ΔGo(I2) = 16,43 kJ/mol
ΔGo(OH-) = -157,2 kJ/mol
Dette giver for hele reaktionen:
ΔGo = 16,43 kJ/mol + (-157,2 kJ/mol) - [-99,2 kJ/mol + (-51,6 kJ/mol)] = 10,03 kJ/mol
-
Ved ligevægt gælder at Gibbs frie energi er lig med nul. Dvs. at ΔG = ΔGo + R·T·ln(K) = 0 ⇒
ΔGo = -R·T·ln(K) ⇒ K = exp(-ΔGo/(R·T)). Her er K lig med ligevægtskonstanten for reaktionen.
For K gælder samtidig (i følge massevirkningsloven eller Guldberg-Waages lov):
K = [OH-]·[I2]/([HIO]·[I-]) ⇒ [I2]/[HIO] = K·[I-]/[OH-]
Loven om vands ionprodukt giver: [OH-] = 10-14/[H+] = 10-14/10-pH = 10-14+pH
Dette giver sammenlagt for forholdet mellem hypoiodsyrlingig og diiod:
[I2]/[HIO] = exp(-ΔGo/(R·T))·[I-]/(10-14+pH M) ⇒
[I2]/[HIO] = exp(-10,03 kJ/mol/(8,314 J/(mol·K)·298 K))·(1,00·10-5 M)/(10-14+8,00 M) ⇒
[I2]/[HIO] = exp(-10030/(8,314·298))·1,00·10-5+14-8,00 ⇒
[I2]/[HIO] = exp(−4,0483)·10 ⇒
[I2]/[HIO] = 0,17452
Dvs. forholdet mellem hypoiodsyrlingig diiod er [I2]/[HIO] = 0,175


Svar på opgave 4: Kviksølv i fisk
-
SnCl2·2H2O har molmassen: 118,71 g/mol + 2·35,453 g/mol + 2·(16,0 g/mol + 2·1,00 g/mol) = 225,62 g/mol
Massen af SnCl2·2H2O i opløsningen findes ved hjælp af ligningen: C = (m/M)/V = m/(M·V), hvor C er stofmængdekoncenrationen af SnCl2 i opløsningen, m er massen af SnCl2·2H2O, der vejes af, M er molmassen af SnCl2·2H2O og V er opløsningens rumfang.
Desuden gælder at antal mol SnCl2·2H2O, som skal vejes af, er lig med antal mol SnCl2 i opløsningen. Man får følgende:
C = (m/M)/V ⇒ 0,264 M = m/(225,62 g/mol·0,5 L) ⇒ m = 0,264 M·(225,62 g/mol·0,5 L) ⇒ m = 0,264·(225,62·0,5) g ⇒
m = 0,264·(225,62·0,5) g = 29,78 g.
Dvs. massen af SnCl2·2H2O, som skal vejes af er 29,78 g
-
I reaktion (I) og (II) går Hg fra frit metal til ionform, dvs. Hg ændrer oxidationstal. Det sker ikke i reaktion (III), hvor Hg findes på ion-form både før og efter reaktionen, Hg-ionen kompleksbindes bare med I-.
-
Man opretter to lister i Ti-Nspire, en for volumen og en for absorbans:
volumen_ml:={0.2,0.4,0.6,0.8,1.} ▸ {0.2,0.4,0.6,0.8,1.}
absorbans:={0.007,0.016,0.03,0.041,0.05} ▸ {0.007,0.016,0.03,0.041,0.05}
Disse lister bruges til at lave en lineær regression som vist på figuren nedenunder:
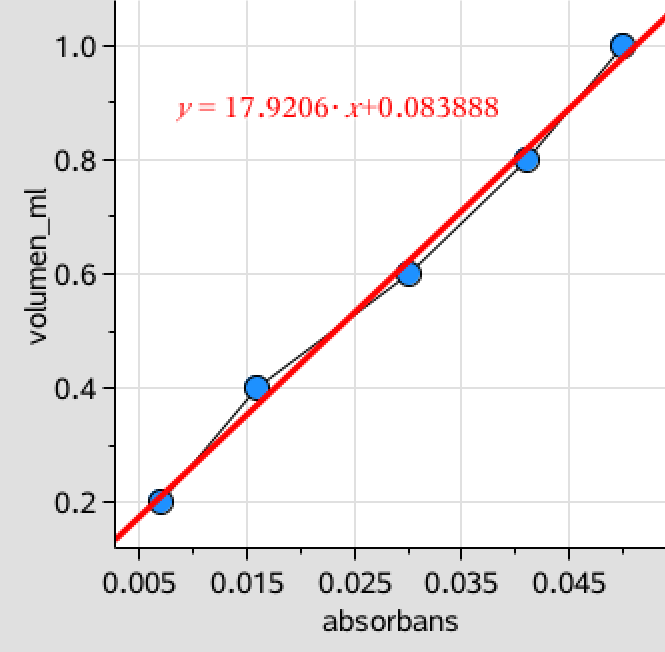
Som det ses kan kuven gennem målepunkterne tilnærmes til en ret linje med ligningen: y = 17,92·x + 0,0839, hvor y er volumenet af opløsningen i mL og x er absorbansen.
-
Bemærk: der er ikke tale om spektrofotometri, men atomabsorbtions-spektrometri. Derfor: omtal ikke Lambert-Beers lov.
En absorbans på 0,036 svarer til en volumen af standardopløsning, der kan findes af den lineære regressionsligning:
volumen af stamopløsning i mL = 17,92·0,036 + 0,0839 = 0,729 mL.
0,729 mL stamopløsning indeholder: 0,729 mL·1,00 μg Hg2+/mL = 0,729·10-6 g Hg2+
Dette stammer fra en fjerdedel af fiskekøddet (25 mL/100 mL), dvs. der var 4·0,729·10-6 g Hg2+ = 2,916 μg Hg2+
Dette giver følgede indhold i forhold til massen af fiskekød: 2,916 μg Hg2+/10,067 g fiskekød = 0,29 μg Hg2+/g fiskekød
I følge EU anbefalingerne bør man ikke indtage mere end 1,6 μg Hg om ugen i forhold til sin legemsvægt i kg.
Hvis man f.eks. vejer 75 kg bør man derfor ikke indtage mere end 75kg·(1,6 μ g Hg)/(0,29 μg Hg2+/g fiskekød om ugen pr. kg. legemsvægt) = 75·(1,6/0,29) g fiskekød om ugen = 413,8 g.
Dvs. en person, der vejer f.eks. 75 kg bør ikke spise mere end 414 g om ugen af den pågældende fisk.
-
Skrubberen fjerner Hg fra udgangsluften ved at kompleksbinde Hg2+-ionen. Ligevægstkonstanten er stor 2·1030 M-4, hvilket betyder, at ligevægten er forskudt mod højre.