

Svar på opgave 1: Ammoniak som grønt brændstof
-
Af reaktionsskemaet fremgår det, at 3·x mol NH3 reagerer med 3·x mol O2 og danner 2·x mol N2 og 6·x mol H2O. Her er x et tal.
Man ved at 3·x = 0,45 mol hvilket giver, at x = 0,15 mol. Antal mol NH3 = 4·0,15 mol = 0,6 mol.
Molmassen af NH3 er 17 g/mol og dermed er masse af NH3: (0,6 mol)·(17 g/mol) = 10,2 g
-
Værdierne for dannelsesentropierne af de indgående stoffer i reaktionen ved 25 °C findes af en tabel. Enheden er J·mol-1·K-1:
So(NH3) = 192,8; So(O2) = 205,15; So(N2) = 191,61 og So(H2O) = 69,95
Dette giver ΔSo = 2·191,61 + 6·69,95 - (4·192,8 + 3·205,15) J·mol-1·K-1 = −583,7
-
Man kender ikke totaltrykket for reaktionsblandingen, men antager at den er en ideal gas, hvorved K er trykuafhgængig.
Ved ligevægt gælder, at ΔGo = -R·T·ln(K). Man finder ΔGo ved 25 °C af en tabel. Enheden er kJ·mol-1:
Go(NH3) = -16,4; Go(O2) = 0; Go(N2) = 0 og Go(H2O) = -237,13
Dette giver ΔGo = [2·0 + 6·(−237,13) - (4·(−16,4) + 3·0)] kJ·mol-1= −1357,18 kJ·mol-1
Dvs. K = exp(-(−1357,18 kJ·mol-1)/[(8,314 J·mol-1·K-1)·(25 + 273,15 K)]) =
exp(1357,18·103/[8,314·(25 + 273,15)]) = 5,615·10237
For at finde enheden for K ser man på ligevægtsudtrykket for reaktionen:
K = (pN2)2·(pNH3)-4·(pO2)-3. (Kun stoffer på gasform indgår).
Da alle tryk har enheden bar, så bliver den samlede enhed: bar-5.
Dvs. K = 5,62·10237 bar-5
Den høje værdi tyder på, at ligevægten er kraftigt forskudt mod højre.
-
Ved omslag af titreringen gælder:
antal mol syre = antal mol base, dvs.
antal mol HCl = antal mol NH3 + antal mol NaOH ⇒
antal mol NH3 = antal mol HCl - antal mol NaOH ⇒
antal mol NH3 = (0,015 L)·(0,0198 M) - (0,01065 L)·(0,02 M) ⇒
antal mol NH3 = 0,000084 mol.
Stofmængdekoncentrationen af NH3 er 0,000084 mol/(0,010 L) = 0,0084 M

Svar på opgave 2: Olivenolie
-
Br2 kan reagere med C=C-dobbeltbindingen, hvorved der sker en additionsreaktion. Dermed forsvinder den brune farve fra Br2 molekyler i vandet.
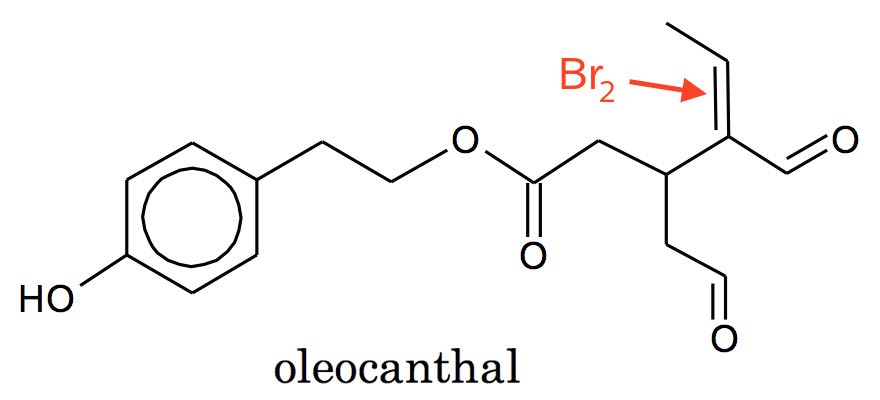
-
Der sker en esterdannelse, hvor en alkohol (tyrosol) reagerer med en syre (A) og danner en ester (B). Samtidig fraspaltets H2O (der sker en kondensation).
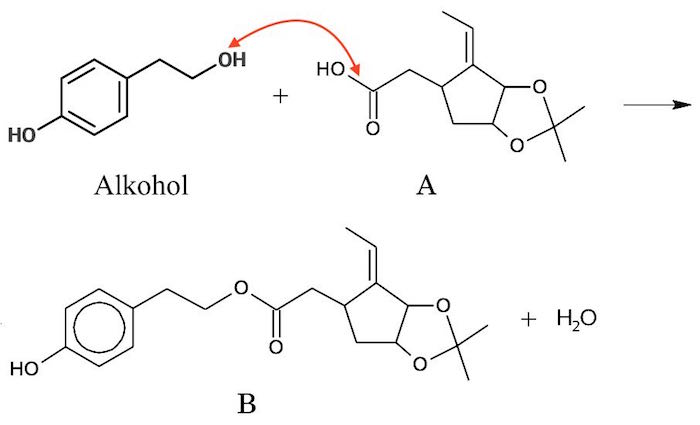
-
Det som adskiller stof A fra oleocanthal, når man taler om bindingstyper, er at stof A indeholder en carboxylsyre og oleocanthal indeholder en phenyl-gruppe.
Carboxylsyren-gruppen i A vil give en bred top ved 3200 til 2200 cm-1 på grund af strækninger i O-H bindingerne. Samtidig vil phenyl-gruppen på oleocanthal give to toppe mellem 1550 og 1350 cm-1 på grund af strækning i C=C bindingerne.

Svar på opgave 3: Guld og cyanid
-
Den formelle molære koncentration er C = n/V = (m/M)/V = m/(M·V), hvor
m er massen af stof,
M er stoffets molmasse og
V er opløsningens rumfang.
Man får, at CNaCN = (99 g)/[(49,0 g/mol)·(100 L)] = 0,020 M
-
pH = 14 - pOH
pOH = 0,5·[pKb,NaCN - log(CNaCN)] (gælder for svag base)
pH = 14 - 0,5·(-log(2,04·10-5) - log(0,020) = 10,8
-
Det er en redoxproces, fordi Au går fra oxidationstrin 0 i Au til oxidationstrin +I i Au(CN)2-. Dette ses af navnet dicyanoaurat(I), hvor "I" står for Au på oxidationstrin I eller Au+.
Samtidig går O fra oxidationstrin 0 i O2 til oxidationstrin -II i OH-.
-
(II) Au(CN)2-(aq) ⇌ Au+(aq) + 2CN-(aq)
(III) Au+(aq) + Zn(s) ⇌ 2Au(s) + Zn2+(aq)
(II) Kompleksbundet Au+ er i ligevægt med opløste Au+-ioner. (III) Opløste Au+-ioner reduceres af Zn. Derved forskydes (II) mod højre og endnu mere Au+ reduceres.
Tilsidst tilsættes svovlsyre, der oxiderer overskydende Zn, men ikke Au, der står til højre for H2 i spændingsrækken.

Svar på opgave 4: Penicillin
-
Der er tale om en amid-dannelse (ligner esterdannelse).
-
Det følger af kurven, at der gælder følgende sammenhæng v = k·[penicillin G]1, hvor k er en konstant.
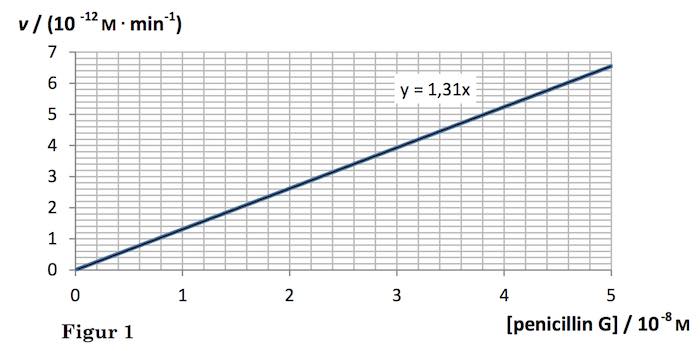
Der gælder, at når reaktionshastigheden er proportional med koncentrationen af en reaktant i første potens, så er reaktionen af 1. orden med hensyn til denne reaktant.
Dvs. reaktionen er af 1. orden
Hastighedskonstanten findes af grafen:
v/(10-12 M·min-1) = 1,31·([penicillin-G]/(10-8 M)) ⇒
v = 1,31·([penicillin-G]/(10-8 M))·(10-12 M·min-1) ⇒
v = (1,31·10-4 min-1)·[penicillin-G]
Dvs. hastighedskonstanten k = 1,31·10-4 min-1
-
v = (6,85·10-10 M·min-1)·([penicillin-G]/([penicillin-G] + 5,22·10-5 M))
Det ses af hastighedsudtrykket, at når [penicillin-G] bliver større end 4,0·10-3 M, så blive nævneren tæt på [penicillin-G], da leddet 5,22·10-5 M bliver så lille i forhold til [penicillin-G], at man kan se bort fra det.
Man får dermed v ≈ 6,85·10-10 M·min-1 eller v ≈ k·[penicillin-G]0.
Da v er tilnærmelsesvis proportional med koncentrationen af [penicillin-G] i nulte potens, så er reaktionen tilnærmelsesvis af nulte orden med hensyn til [penicillin-G] for [penicillin-G] > 4,0·10-3 M.
Dette ses også af grafen, der går mod en vandret linje for store værdier af [penicillin-G]:
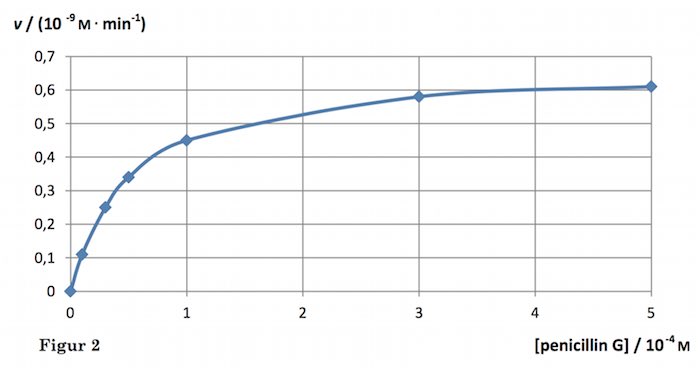
Bemærk at [penicillin-G] = 4,0·10-3 M er uden for skalaen.
-
Man deler tripeptidet op langs med peptidbindingerne:
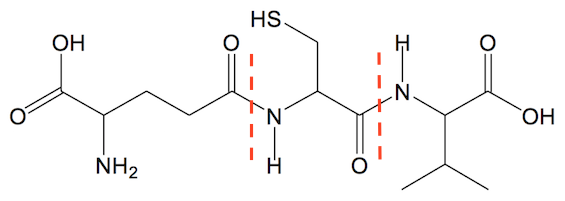
Det giver følgende aminosyrer:
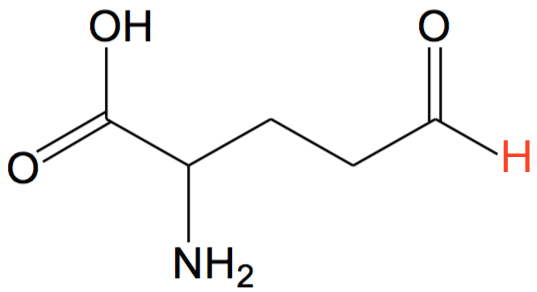
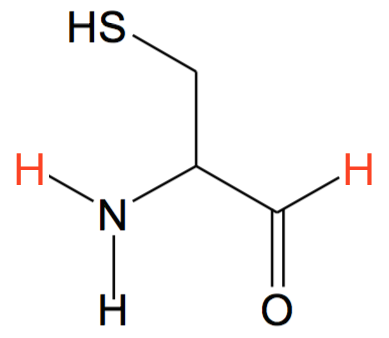
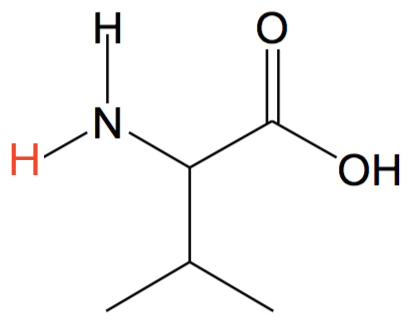
-
Det er usikkert om "andelen" af et stof betyder molbrøken af stoffet eller syrebrøken henholdsvis basebrøken. I praksis giver resultatet det samme uanset hvad, og i det følgende kan andelen kaldet x derfor have alle tre betydninger.
Man deler Bjerrumdiagrammet op i to: et for Ampicilin (blå og rød kurve) og et for Penicilin G (sort kurve).
Ampicilin: Man indsætter A, B og C omkring de farvede streger.
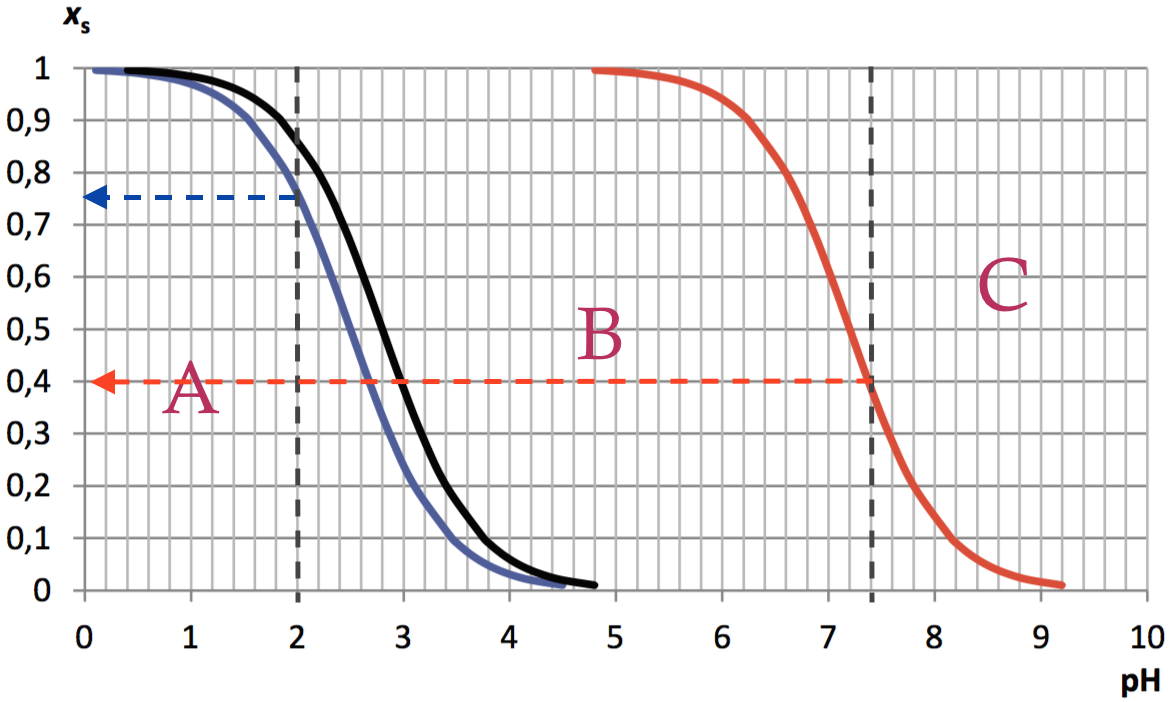
Man ser først, at xC er 0 ved pH = 2,0, idet den røde kurve ligger i toppen af diagrammet. Dette betyder, at xA og xB kan aflæses af den blå kurve alene:
xA ved pH = 2 aflæses til 0,75. (vist med blå pil).
xB ved pH = 2 er 1 - xA = 1 - 0,75 = 0,25.
Ved pH = 7,4 får man, at den blå kurve ligger i bunden af diagrammet og dermed er xA lig med 0. Dvs. at xB og xC kan aflæses af den røde kurve alene.
xB ved pH = 7,4 aflæses til 0,4 (vist med rød pil).
xC ved pH = 7,4 er 1 - 0,4 = 0,6
Penicilin G: Man indsætter D og E omkring den sorte streg.
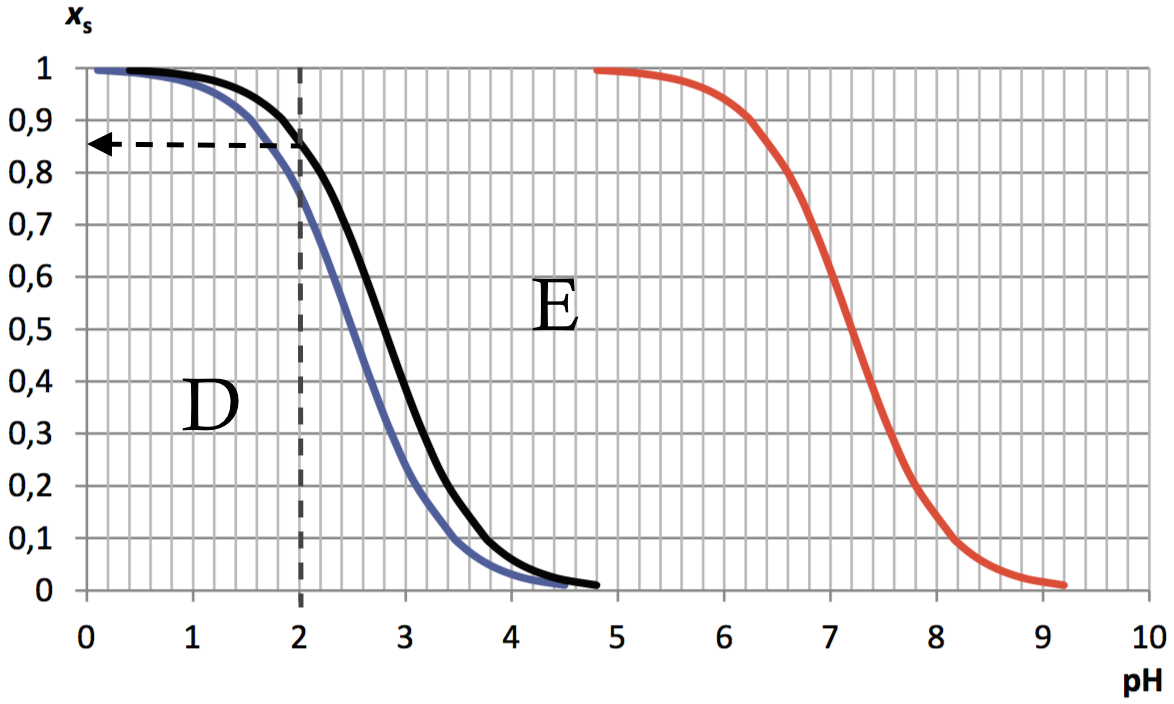
Den sorte kurve svarer til det korresponderende syrebasepar D/E.
xD ved pH = 2 aflæses til 0,85 (vist med sort pil).
xE ved pH = 2 er 1 - 0,85 = 0,15.
xD ved pH = 7,4 er 0 da den sorte kurve ligger i bunden af diagrammet
xE ved pH = 7,4 er 1,0 - 0 = 1,0.
-
Ved pH = 7,4 findes Ampicilin som en blanding af formerne B og C, mens penicilin-G mest findes på formen E. Alle disse er ioner, hvilket gør dem sværtopløselige i organisk opløsningsmiddel. B har to ladninger, hvilket vil betyde, at Ampicilin er mere vandopløseligt end Penicilin G og dermed har lavere KF.
De to stoffer er ens i opbygning bortset fra, at C har en ekstra -NH2 gruppe, der gør B og C lidt mere vandopløseligt end E og dermed har lavere KF.
Den lavere teoretiske KF værdi for Ampicilin stemmer med det målte.