
Svar på opgave 1: Hydrogeniodids spaltning
-
For en nulte-ordens reaktion gælder: C(t) er lineær,
for en første-ordens reaktion gælder: ln(C(t)) er lineær og
for en anden-ordens reaktion gælder: 1/C(t) er lineær,
Her er C(t) koncentrationen af det målte stof (her HI) som funktion af tiden t.
Kurve tre passer med en lineær funktion.
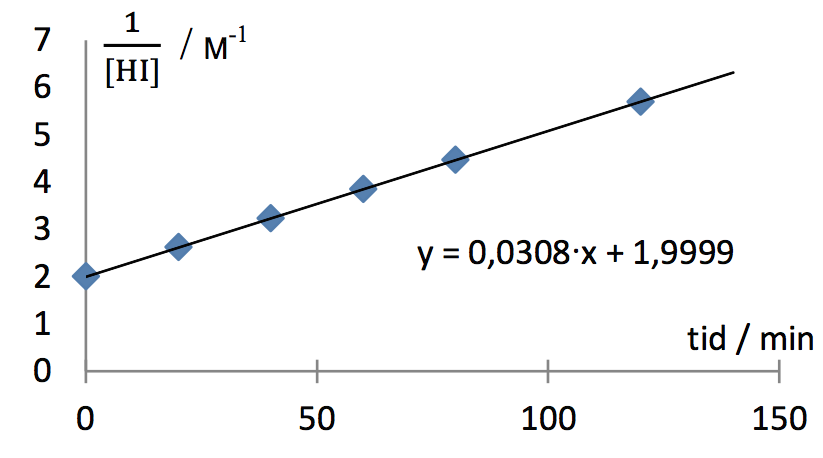
Derfor er reaktionen anden-ordens
-
Da slut-koncentrationen er det halve af start-koncentrationen kan man bruge formlen for halvering af koncentrationen for en anden ordens reaktion:
T1/2 = 1/(c0·k), hvor
T1/2 er halveringstiden,
c0 er start-koncentrationen = 0,4 M og
k er hastighedskonstanten for reaktionen = 0,0308 M-1·min-1
Det giver: T1/2 = 1/(0,4·0,0308) min = 81,17 min
Dvs. det tager 81,2 min for koncentrationen af HI at gå fra 0,4 M til 0,2 M.
-
Arrhenius-ligningen: k = A·exp(-Ea/(R·T)). Dette kan omskrives til:
ln(k) = ln(A) - (Ea/R)·(1/T)
Her er
Ea aktiveringsenergien,
A er en konstant og
T er kelvintemperatiuren.
Dvs. afbilder man ln(k) mod 1/T og får en ret linje, så vil hældningen (α) være Ea/R og dermed gælder: Ea = α·R.
I Ti-Nspire opretter man lister med temp (Kelvin-temperaturen), k (hastighedskonstanterne), ln(k) (den naturlige logaritme til hastighedskonstanterne) og rect (den reciprokke Kelvin-temperatur):
temp:={283,356,393,427,508}+273.15 ▸ {556.15,629.15,666.15,700.15,781.15}
k:={2.11*10-5,1.81*10-3,0.0131,0.0348,2.37} ▸ {0.0000211,0.00181,0.0131,0.0348,2.37}
lnk:=ln(k) ▸ {−10.76624,−6.314428,−4.335143,−3.358138,0.8628900}
rect:=1/temp ▸ {0.0017981,0.0015894,0.0015012,0.0014283,0.0012802}
Man laver herefter en lineær regression med ln(x) som x-værdier og 1/T som y-værdier:
LinRegMx rect,lnk,1: CopyVar stat.RegEqn,f1: stat.results ▸
[["Titel","Lineær regression (mx+b)"]
["RegEqn","m*x+b"]
["m",−21984.67]
["b",28.62180]
["r²",0.992983]
["r",−0.9964853]
["Resid","{...}"]]Regressions-ligningen bliver: ln(k) = 28,62 - 2199·(1/T), dvs. man har: α = 2199 K.
Man får: Ea = (2199 K)·(8,314 J/(mol·K)) = 182,8 kJ/mol

Svar på opgave 2: AHA-frugtsyre til peeling
-
Navnet er 2-hydroxyethansyre
Forklaring: den vigtigst funktionelle gruppe er COOH (carboxylsyre). Den længste kulstofkæde, der indeholder denne er ethansyre. C' et i COOH nummeres med et 1-tal og det andet C' med et 2-tal. OH sidder på det andet C og kommer derfor til at hedde 2-hydroxy.
Dette sættes sammen med ethansyre (hovedkæden), så dennes navn står sidst. OH hedder hydroxy-, når gruppen ikke er vigstigste funktionelle gruppe; hvis den er, så kommer stoffet til at hedde alkohol (eller fenol) til sidst.
-
Formlen for den formelle koncentration af mælkesyre (C) er:
C = m/(M·V), hvor
m er massen af mælkesyre = 3 g,
M er molmassen af mælkesyre = 90,08 g/mol og
V er opløsnigense rumfang = 100 mL = 0,1 L.
Dette giver C = 3 g/((90,08 g/mol)·(0,1 L)) = 0,333 M, hvilket viser det ønskede for den formelle koncentration af mælkesyre.
-
Man bruger formlen for pH af en svag syre, da pKs = 3,86, dels er større end 3 og da den formelle koncentration af syren er større end 0,1 M.
pH = 0,5·(pKs - log(C)) = 0,5·(3,86 - log(0,333) = 2,1688
Dvs. pH er 2,17
-
Man bruger puffer-ligningen for mælkesyre (S) og dens korresponderende base (B) til at beregne volumenet med.
pH = pKs + log(nB/nS), hvor
nB er stofmængden (eller antal mol) af den korresponderende base til mælkesyre og
nS er stofmængden (eller antal mol) af mælkesyre.
Der gælder, at antal mol tilsat NaOH (nNaOH) er lig med nB.
Deraf følger: nS = nS,0 - nNaOH, hvor nS,0 er start-stofmængden af S, som er (0,333 M)·(0,1 L) = 0,0333 mol. Dette indsættes i ligningen, og man får for nNaOH:
3,5 = 3,86 + log((0,0333 mol - nNaOH)/(0,0333 mol)) ⇒ nNaOH = 0,018764 mol
Rumfanget af tilsat NaOH-opløsning (V) fås til sidst af formlen CNaOH = nNaOH/V ⇒
V = nNaOH/CNaOH, hvor
CNaOH er koncentrationen af NaOH = 1 M.
V = (0,018764 mol)/(1 M) = 0,018764 L = (0,018764 L)·(1000 mL/L) = 18,764 mL
Dvs. der skal tilsættes 18,8 mL NaOH
-
Man kender ikke molekyleformlen, der normalt skal kendes for at kunne bruge et NMR-spektrum. Man gør derfor den antagelse, at esterdelen er den enklest mulige, nemlig en alkan. Desuden antages, at det samlede integrale (den røde kurve i NMR-diagrammet) er lig med det samlede antal H'er i molekylet.
Syredelen af molekylet (den del som man kender) indeholder 5 H. Da Integralet er 12, så skal ester-delen have 7 H. Samtidig skal der være et H, som giver en septet. Det giver den viste mulighed: CH3-CHOH-COO-CH(CH3)2 (isopropyl-2-hydroxypropanoat).
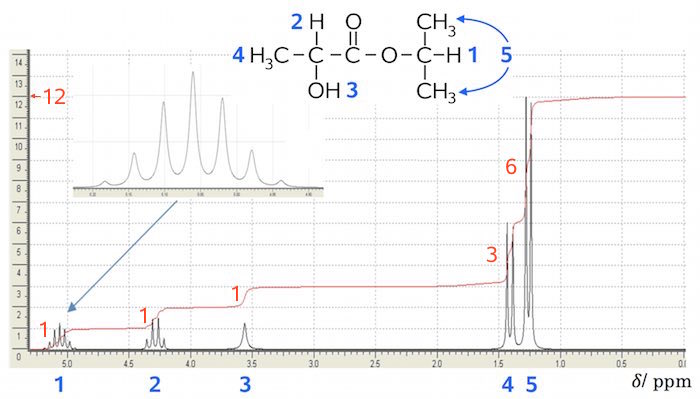
På ovenstående billede er toppene nummereret 1-6 med fede blå tal. En strukturformel for stoffet er vist øverst. Her er de H'er, der svarer til toppene, nummereret på samme måde. De røde normale tal viser integralet for hver top.
Antallet af H'er for hver top er lig med integralet gange et naturligt tal. Hvilket tal, der er det rigtige, kommer an på en nærmere analyse. Her antages, at tallet er 1, da det er mest nærliggende.
Top 1: En septet med integralet 1 og kemisk skift på 5,1. At splittet er en septet kommer af, at der sidder 6 H på nabo-C'erne til det C, som H'et sidder på. (Splittet følger reglen om n+1, hvor n som nævnt er 6). Integralet kommer af, at der er 1 H på det pågældende C og det høje kemiske skift kommer af, at H'et deshieldes af O'et der er bundet til det samme C, som H'et.
Top 2: En kvartet med integralet 1 og et kemisk skift på 4,3. At splittet er en kvartet kommer af, at der sammenlagt sidder 3 H på nabo-C'erne til det C, som H'et sidder på. Integralet passer med, at der sidder 1 H på det pågældende C. Det høje kemiske skift skyldes deshielding fra O'et, der er bundet til det C som H'et sidder på.
Top 3: En bred singlet med integralet 1 og et kemisk skift på 3,6. At splittet er en singlet passer med at H'et sidder på et O og ikke et C, hvilket gør, at det ikke kan koble med andre H'er. At toppen er bred skyldes at H'er ikke kun påvirkes af det O, som det sidder på, men også af O'er fra andre molekyler gennem hydrogenbindinger. Integralet på 1 passer med, at der er 1 H på O'et. Det kemiske skift er højt på grund af at H'et deshieldes af O'et. (Det kemiske skift for H i -OH varierer mellem 0,5 og 4,5 afhængig af opløsningsmiddel, temperatur og pH.)
Top 4: En dublet med integralet 3 og et kemisk skift på 1,4. At splittet er en dublet kommer af, at der sammenlagt sidder 1 H på nabo-C'erne til det C, som H'et sidder på. Integralet passer med, at der sidder 3 H på det pågældende C. Det lave kemiske skift skyldes manglende deshielding fra eletronegative atomer.
Top 5: En dublet med integralet 6 og et kemisk skift på 1,25. At splittet er en dublet kommer af, at der sammenlagt sidder 1 H på nabo-C'erne til det C, som H'et sidder på. Integralet passer med, at der sidder 6 H på de 2 C, der har samme omgivelser. Det lave kemiske skift skyldes manglende deshielding fra eletronegative atomer.

Svar på opgave 3: Ligevægten mellem chromat og dichromat
-
K = [Cr2O72-]/([CrO42-]2·[H+]2)
-
Le Chateliers princip gør, at ligevægten forskydes mod højre, når H+ tilsættes eftersom H+ er en reaktant. Dvs. jo surere, jo længere til højre.
Da Cromforbindelsen på højre side er orange mens den på venstre er gul vil det sige, at sur opløsning er orange, mens basisk opløsning er gul.
-
Der gælder, at ΔH⊖ er summen af de molære dannelses-entalpier for produkterne (ganget med produkternes koefficienter) minus summen af de molære dannelses-entalpier for reaktanterne (ganget med disses koefficienter).
Man har følgende molære dannelses-enthalpier:
Δf H⊖dichromat = -1490,3 kJ/mol
Δf H⊖chromat = -881.15 kJ/mol
Δf H⊖H+ = 0
Δf H⊖H2O = -285,83 kJ/mol
Dvs. ΔH⊖ = (−1490,3 - 285,83 - 2·(−881.15)) kJ/mol = −13,83 kJ/mol
ΔH⊖ < 0 ⇒ reaktionen mod højre er eksoterm, dvs. der sker varmeudvikling ved den reaktion, der forløber mod højre.
-
Den termodynamiske formel for ligevægtskonstanten (K) er:
K = exp(-ΔG⊖/(R·T)), hvor
ΔG⊖ er den molære Gibbs fri energi for reaktionen og
T er Kelvin-temperaturen = 25 + 273,15 K = 298,15 K.
ΔG⊖ beregnes ved hjælp af de molære Gibbs frie energier for dannelsen af de indgående stoffer. Formlen for beregningen svarer til beregningen af ΔH⊖ ovenfor.
I en tabel finder man de molære dannelses Gibbs fri energier for de indgående stoffer:
Δf G⊖dichromat = -1301,2 kJ/mol
Δf G⊖chromat = -727,8 kJ/mol
Δf G⊖H+ = 0
Δf G⊖H2O = -237,13 kJ/mol
Dette giver: ΔG⊖ = (2·(-727,8) + 2·0 - (-1301,2 - 237,13)) kJ/mol = -82,700 kJ/mol.
Dette indsættes i formlen: K = exp(82700/(8,314·(25+273,15))) M-3 = 3,08·1014 M-3
At enheden er M-3 ses af ligevægstudtrykket [Cr2O72-]/([CrO42-]2·[H+]2), hvor koncentrationerne har enheden M og hele brøken derfor har enheden M-3.
-
Man har følgende to ligninger med to ubekendte C1 og C2 i følge Lambert Beers lov og ved at antage, at absorbansen af to stoffer i samme opløsning kan lægges sammen:
A345 = ε1,345·C1 + ε2,345·C2.
A370 = ε1,370·C1 + ε2,370·C2.
Her er
A345 den samlede absorbans af opløsningen ved bølgelængden 345 nm,
A370 den samlede absorbans af opløsningen ved bølgelængden 370 nm,
ε1,345 den specifikke absorbans for chromat ved bølgelængden 345 nm,
ε2,345 den specifikke absorbans for dichromat ved bølgelængden 345 nm,
ε1,370 den specifikke absorbans for chromat ved bølgelængden 370 nm,
ε2,370 den specifikke absorbans for dichromat ved bølgelængden 370 nm,
C1 koncentrationen af chromat og
C2 koncentrationen af dichromat.
Tallene fra tabellen er:

Disse tal indsættes, og der ganges med 1 cm, som er kuvette-bredden:
0,470 = (1 cm)·(1,84 103 M-1cm-1)·C1 + (1 cm)·(1,07·103 M-1cm-1)·C2 og
1,02 = (1 cm)·(4,81·103 M-1cm-1)·C1 + (1 cm)·(7,28·102 M-1cm-1)·C2.
Dette giver C1 = 1,97·10-4 M og C2 = 1,01·10-4 M
Dvs. koncentrationen af chromat er 1,97·10-4 M og koncentrationen af dichromat er 1,01·10-4 M

Svar på opgave 4: Chlorogensyre
-
De funktionelle grupper er: carboxylsyre (blå ring), ester (grøn ring), alkohol (røde ringe), fenol (gule ringe) og alken (violet ring).
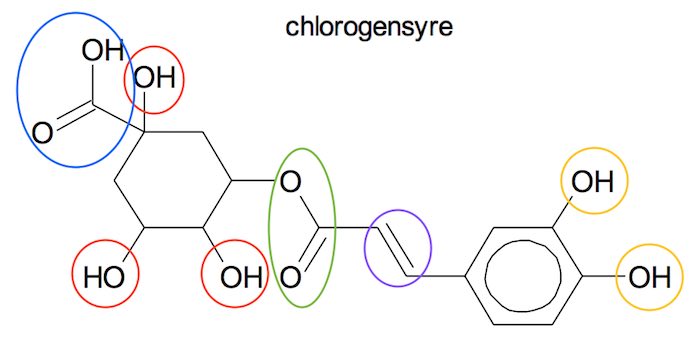
-
Der er tale om stillings-isomeri.
Dette er et eksempel på struktur-isomeri, der indbefatter kæde-isomeri, stillings-isomeri og funktions-isomeri. Kulstofkæden er den samme (dvs. det er ikke kæde-isomeri), de funktionelle grupper er de samme (dvs. det er ikke funktions-isomeri). Den eneste forskel er, at der er ændret på placeringen af to funktionelle grupper. Udover struktur-isomeri, så findes også stereo-isomeri.
-
Reaktion 1 er en hydrolyse :
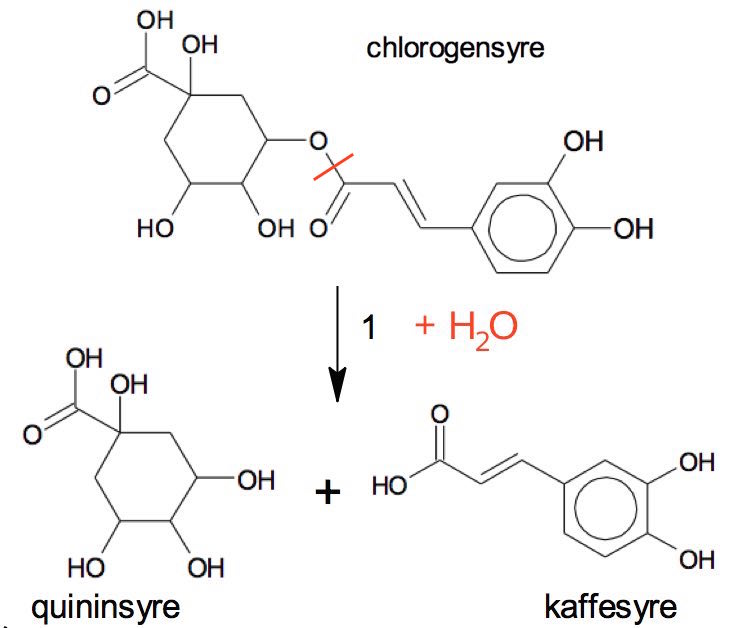
En ester-binding spaltes ved tilsætning af vand (desuden tilsættes varme og en katalysator i form af syre eller base).
Reaktion 4 er en additionsproces :
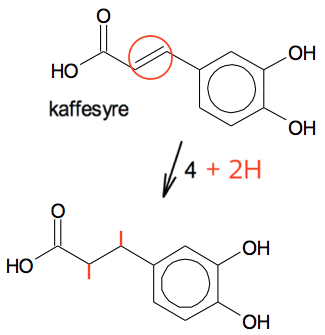
To H-atomer adderes til C'erne i alken-dobbeltbindingen.
Det kan også ses som en redoxproces: De to C'er få mindsket deres oxidationstal med 1 for hvert H-atom, som de bindes til.
-
Chlorogen er uladet på syreform og ionisk på baseform. Dvs. chlorogen er mere vandopløseligt og mindre opløseligt i upolært opløsningsmiddel på baseform end på syreform. Ioniske grupper i et organisk stof overtrumfer andre hydrofile grupper.
Af Bjerrumdiagrammet nedenunder ses, at ved pH = 3 er chlorogensyre overvejende på syreform og omvendt ved pH = 7,0, hvor den overvejende er på baseform.
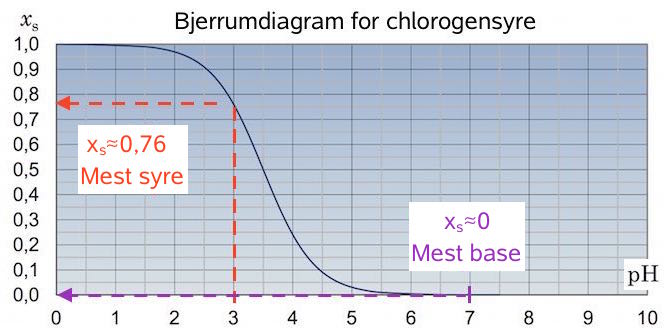
For KF gælder, at jo højere opløselighed af stoffet i upolært opløsningsmiddel og samtidig jo mindre opløseligehed i vand, jo større KF.
Dette vil her sige, at jo højere pH, jo mindre KF, hvilket stemmer med at KF for chlorogensyre er mindre ved pH 7 end ved pH 3.
-
Gruppe 1: Ved almindelige diæt dannes 7 μmol/døgn hippursyre og ikke andre af de stoffer man har valgt at undersøge for. Dette er blindprøven eller kontrolprøven, der skal bruges til at vurdere, hvor meget chlorogensyre til betyder for dannelsen af de forskellige stoffer.
Gruppe 2: Der dannes kun hippursyre, dvs. kun reaktionsvej 2-3 bruges.
Gruppe 3: Der dannes overvejende hippursyre, dvs. reaktionsvej 4-5-6-3 bruges mest. Rekationsvej 9 bruges i mindre grad hvoved der dannes ferulasyre. Reaktionsvejene 4-5-7 og 8, der danner 3-hydroxyhippursyre henholdsvis isoferulasyre bruges kun lidt.
Gruppe 4: Man skulle tro at gruppe 4 ville give summen af gruppe 2 og gruppe 3, da chlorogensyre altid starter med at spaltes til quininsyre og kaffesyre, det er ikke helt tilfældet. Af en eller anden grund hæmmes reaktionsvej 9, så der dannes mindre ferulasyre end i forsøget med gruppe 3.