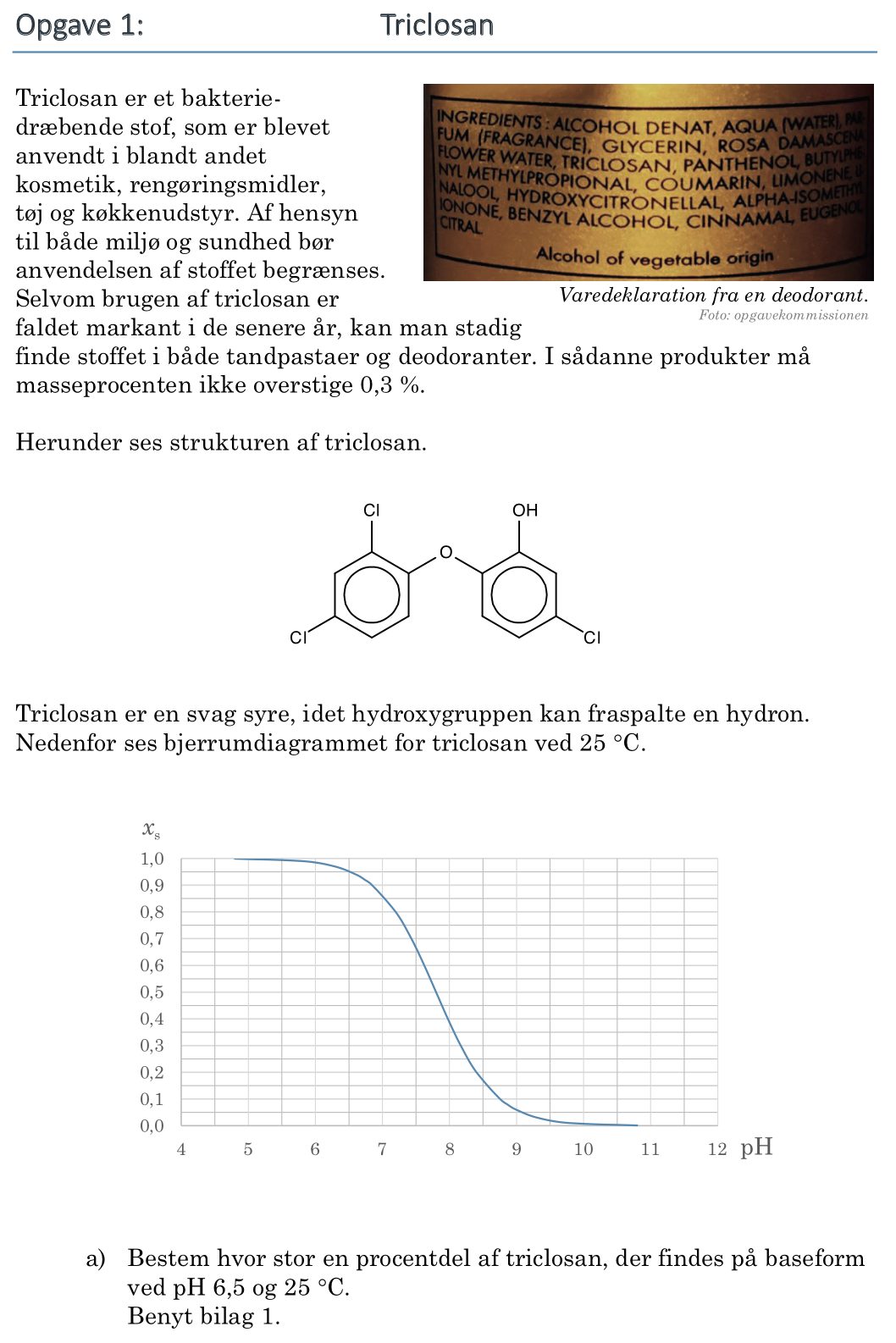
Svar på opgave 1: Timianolie
-
På billedet nedenunder er de manglede C'er og H'er indtegnet.
-
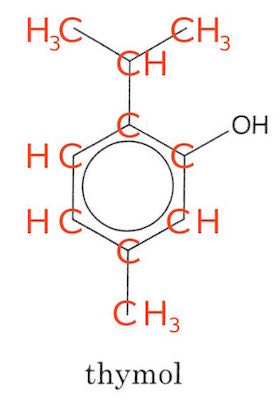
På billedet nedenunder er de funktionelle grupper vist og navngivet.
-
Stoffer som indeholder dobbeltbindinger affarver bromvand ved addering af Br. Dvs. γ-terpen affarver bromvand og er dermed stof 2.
2,4-dinitrophenylhydrazin danner gult bundfald med C=O grupper, dvs. med aldehyder og ketoner. Dermed er stof 4 campher.
Hydroxygrupper giver et bredt absorptionsbånd ved ca. 3400 cm-1 på IR spectret. En benzenring giver bånd ved 1600 cm-1 og 1470 cm-1. Dette kan bruges til at identificere borneol og p-cymen.
Thymol vil vise begge typer af bånd.

Svar på opgave 2: Medicin til behandling af epilepsi
-
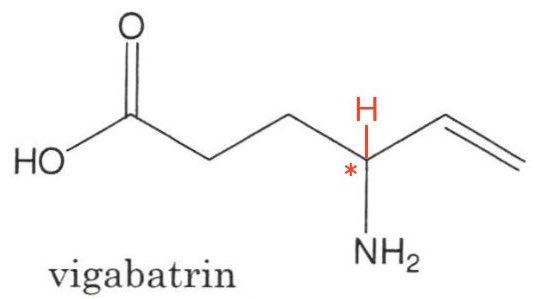
På nedenstående billede er et asymmetrisk kulstofatom markeret med *. Et H-atom indtegnet for at vise, at det påhældende C-atom er bundet til fire forskellige grupper. Det asymmetriske kulstofatom gør, at stoffet udviser spejlbilledisomeri.
-
Man finder den højst prioriterede funktionelle gruppe, som er carboxylsyren. Dernæst finder man den længste kulstofkæde, som indeholder syregruppen. Kulstofkæden nummereres, så C-atomet i syregruppen får nummer 1. Dette er samlet vist nedenunder:
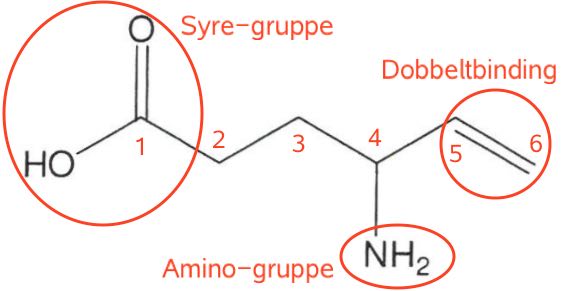
Den længste kulstofkæde er hexen. Dobbeltbindingen sidder, som det ses ovenfor, mellem C-5 og C-6. Sidegruppen -NH2 (en amino-gruppe) sidder på C-4.
Man har:
- Vigtigste funktionelle gruppe: syre
- Længste kulstofkæde, der indeholder syren: hex-5-en
- Sidegruppe på denne kæde: 4-amino.
Dette sættes sammen til: 4-aminohex-5-ensyre
-
Der gælder følgende formel for molmassen af H2A (MH2A):
MH2A = mH2A/nH2A, hvor
mH2A = 0,317 g er massen af H2A i prøven og
nH2A er antal mol H2A.
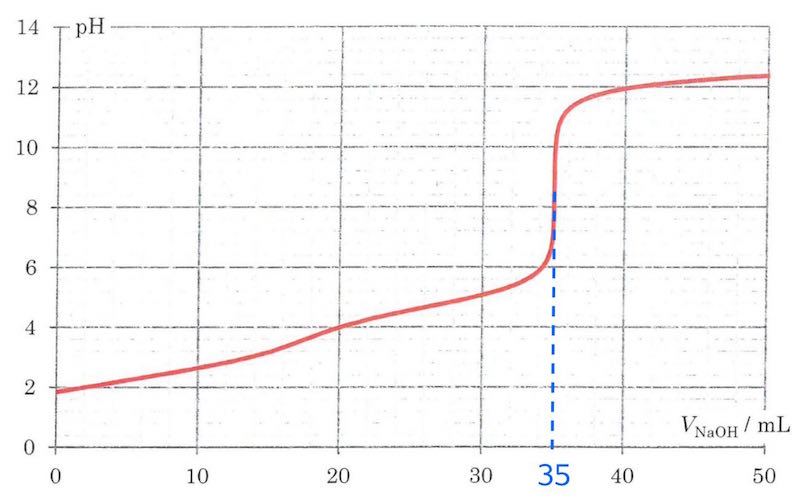
Molmassen af H2A beregnes ud fra titrerkurven. Man aflæser, at der er tilsat 35 mL NaOH-opløsning ved det store omslag. Her er alle H+ neutraliseret, og der gælder:
2·nH2A = nNaOH ⇒ nH2A = 0,5·nNaOH, her er
nH2A antal mol H2A i prøven og
nNaOH er det antal mol NaOH, som er tilsat ved titrering.
Der gælder desuden, at CNaOH = nNaOH/VNaOH ⇒ nNaOH = CNaOH·VNaOH, hvor
CNaOH = 0,124 M er koncentrationen af NaOH (titrator)
VNaOH = 35 mL er det tilsatte volumen af NaOH-opløsning, som aflæses af kurven som vist:
Man har nu samlet for molmassen af H2A:
MH2A = mH2A/(CNaOH·VNaOH) =
(0,317 g)/[(0,124 M)·(35 mL)] = (0,317 g)/[(0,124 mol/L)·(35·10-3 L)] =
0,317/(0,124·35·10-3) g/mol = 146 g/mol
-
Man bestemmer molekyle formlen for stoffet, som har den foreløbige formel: CxHyOz. Der gælder:
x = (41,11 %)·(146/12) = 5,00 ≈ 5
y = (4,14 %)·(146/1) = 6,04 ≈ 6
z = (54,75 %)·(146/16) = 5,00 ≈ 5
Dvs. molekyleformlen for H2A er C5H6O5.
Man ved, at syren er organisk og dihydron, og derfor, at der indgår 2 carboxylsyregrupper i den. Man har den delvise strukturformel: C3H4O(COOH)2. Man betragter dernæst 1H-NMR-spektret for at se, hvilke andre grupper, som må indgå:
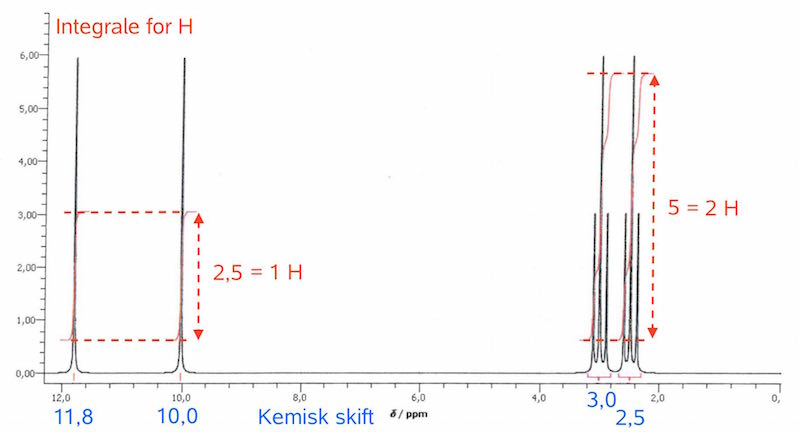
De to toppe til venstre stammer fra de to -COOH grupper. Det følger af, at toppene er singletter, har integralet 1 hver og har et kemisk skift i intervallet 10-12. At de er singletter følger af, at H'et i COOH sidder på et O og ikke et C. At H'et i -COOH har kemisk skift i intervallet 10-12 skyldes, at det deshieldes af to O'er der sidder på samme C-atom, som det selv er forbundet til. At integralet over toppene svarer til 1 H følger af, at der er 6 H, og at det målte integrale over hver top svarer til en sjettedel af integralet over alle H'erne.
Dermed er der to toppe tilbage. De ligger i intervallet 2,5-3 med hensyn til kemisk skift, har hver 2 H og er tripletter. Dermed må de stamme fra 2 CH2- grupper, der er forbundet. At de har et lavt kemisk skift passer med, at C kun i ringe grad deshielder H. At de er tripletter viser, at de 2 CH2- grupper sidder ved siden af hinanden i kulstofkæden. Splittet på 3 i hver top viser nemlig, at der er 2 H på det tilstødende C.
Dette giver den delvise strukturformel (-CH2-CH2-)(>C=O)(-COOH)2, der har følgende mulighed:
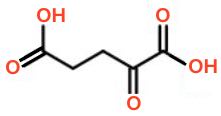
Derfor må H2A være α-Ketoglutarsyre, som er det viste stof.
På billedet nedenunder er toppene i 1H-NMR-spektret forklaret.
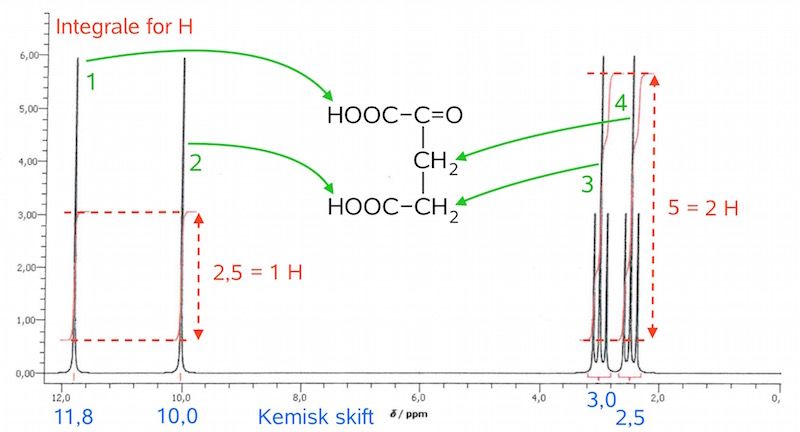
1) Integrale = 1 H, skift = 11,8, split = singlet. Det høje kemiske skift skyldes, at det både deshieldes af O fra COO og C=O. Det er en singlet, fordi H er bundet til O og ikke C.
2) Integrale = 1 H, skift = 10,0, split = singlet. H'et har et skift, der er mindre end det forrige, fordi H'et kun deshieldes O'erne fra dens egen carboxylgruppe og ikke af et O på det tilstødende C-atom. Det er en singlet af samme grund som før.
3) Integrale = 2 H, skift = 3, split = triplet. H'erne har et lavt kemisk skift, fordi de kun deshieldes af det C, som det sidder på og derudover to O fra den stilstødende COOH gruppe. Det er en triplet, da der er 2 H-atomer på det tilstødende C-atom.
4) Integrale = 2 H, skift = 2,5, split = triplet. H'erne har et endnu lavere skift end den foregående, fordi de kun deshieldes af et O på det tilstødende C-atom og ikke to som ovenfor. Det er en triplet af samme grund som den forrige top.
Svar på opgave 3: Forgrenede aminosyrer i muskler
-
Den formelle koncentration af leucin (C) beregnes med formlen
C = m/M·V, hvor
m = 1250 mg er massen af leucin,
M = 131,17 g/mol er molmassen af leucin og
V = 330 mL er opløsningens rumfang.
Man får C = (1250·10-3 g)/[(131,17 g/mol)·(330·10-3 L)] = 1250/(131,17·330) mol/L = 28,9 mM
-
Aminosyrerne kan sættes sammen ved hjælp af peptidbindinger som vist nedenunder med røde pile:
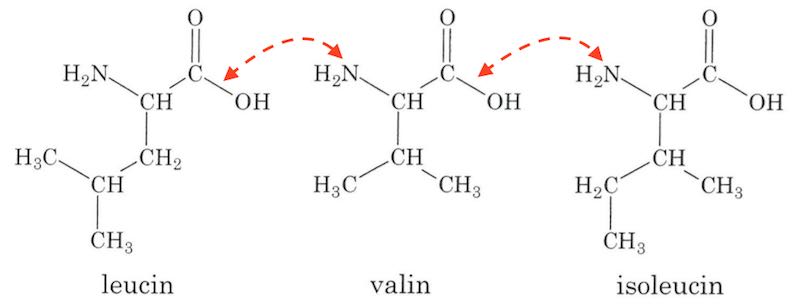
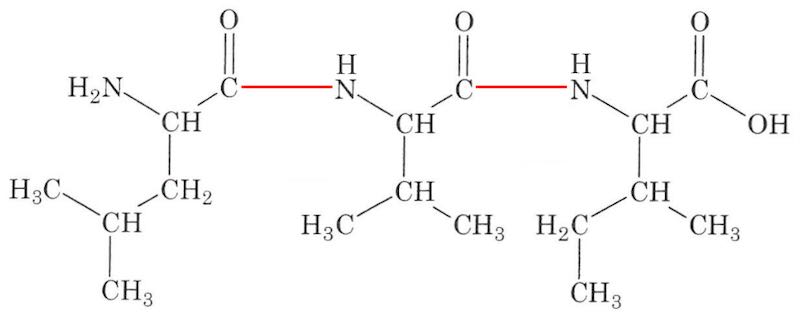
I hver peptidbinding fraspaltes et H2O-molekyle, dvs. der er tale om en kondensations-reaktion. Nedenfor er vist, hvordan aminosyrerne kan sættes sammen i en tripeptid.
-
Nedenfor er vist grafen for v(c). Det ses, at når startkoncentrationnen af leucin øges, så går initialhastigheden mod 0,56 M/min. Dette er vist med en grøn vandret linje.
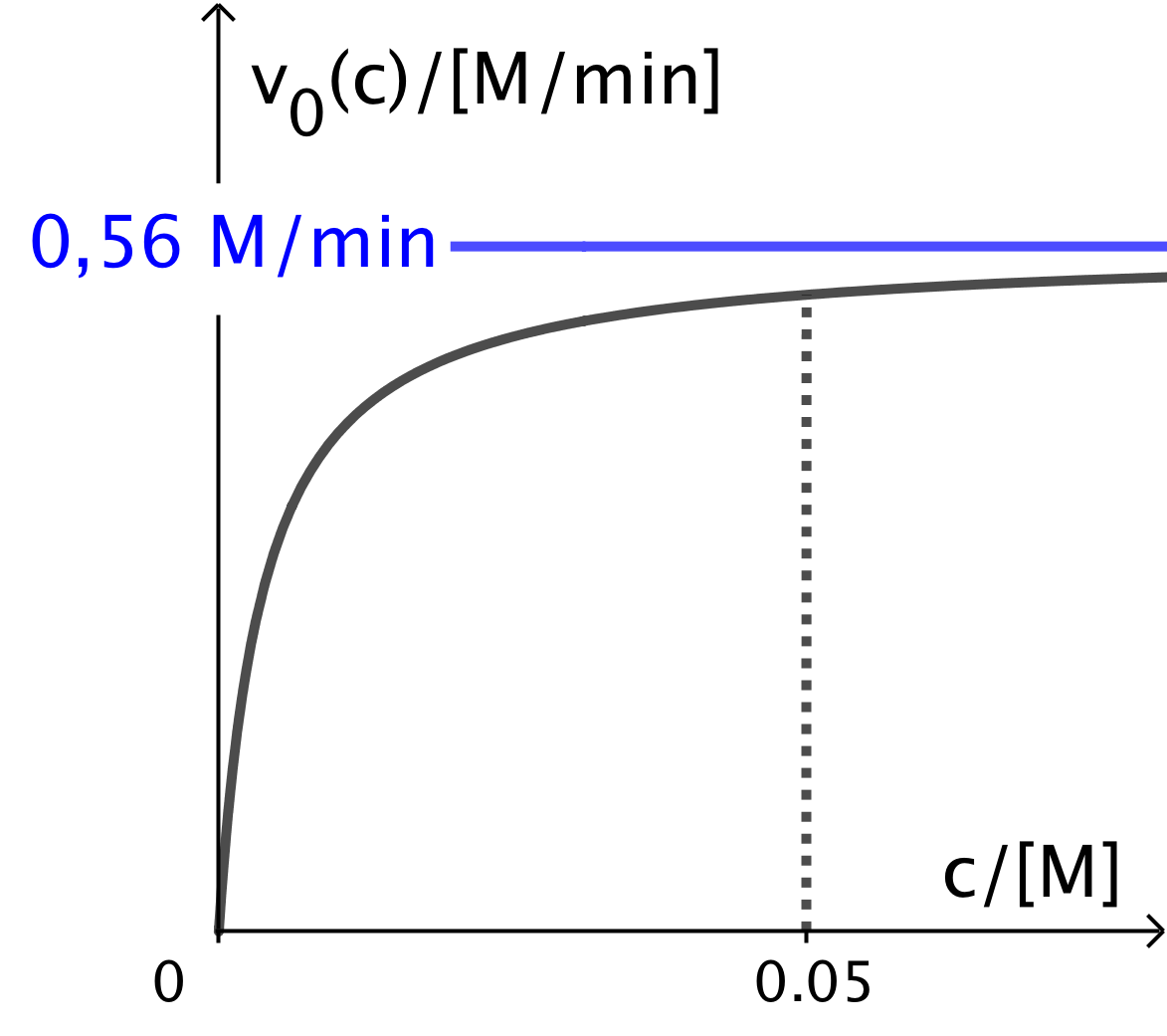
Fra en bestemt initialkoncentration og derover vil hastigheden være så tæt på 0,56 M/min, at man ikke kan måle nogen ændring. Over den koncentration kan man regne reaktionen for at være af nulte orden, idet v(c) er konstant og ca. lig med 0,56 M/min.
På grafen er valgt koncentrationen c(leucin) = 0,05 M, som den koncentration, jvor intervallet for nulte ordens reaktion starter. Dvs. intervallet, hvor reaktionen kan anses for at være nulte orden er c(leucin) ∈ ]0,05 M;∞[
På grafen nedenunder er yderlige vist, at for koncentrationen gående mod 0, så vil grafen nærme sig en ret linje. Denne linje er v(c) = (a/b)·c = 147·c for leucin. Grafen nærmer sig denne linje for c ≈ 0,002 M.
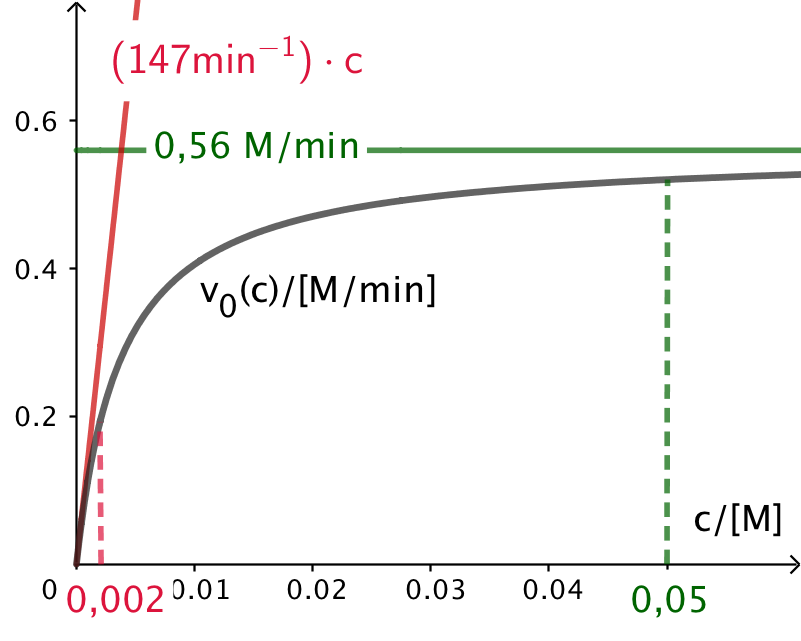
I opgaven ses på udtrykket v(0) = a·c(0)/(b+c(0)), dvs. start-reaktionshastigheden som funktion af startkoncentrationen af leucin. Man kan imidlertid bruge samme udtryk til at vurdere v(t), dvs. reaktionshastigheden som funktion af tiden, idet man blot indsætter c(t), der er koncentrationen af leucin som funktion af tiden. Man får:
v(t) = a·c(t)/(b+c(t))
Hvis b<<c(t) får man v(t) ≈ a, der som nævnt giver en nulte ordens reaktion.
Hvis b>>c(t) får man v(t) ≈ (a/b)·c(t), der giver en første ordens reaktion, idet a/b er en konstant.
Hvis man lader reaktionen starte ved en høj koncentration som f.eks. 0,1 M, så vil man først se grafen for c(t) være en ret linje med negativ hældning et stykke tid indtil koncentrationen er faldet til under 0,05 M. Derefter vil der være en overgang, der ikke følger nogen bestemt orden. Til sidst - for c < 0,002 M - vil grafen være en aftagende eksponentialfunktion, der svarer til en reaktion af første orden. Dette er skitseret nedenunder:
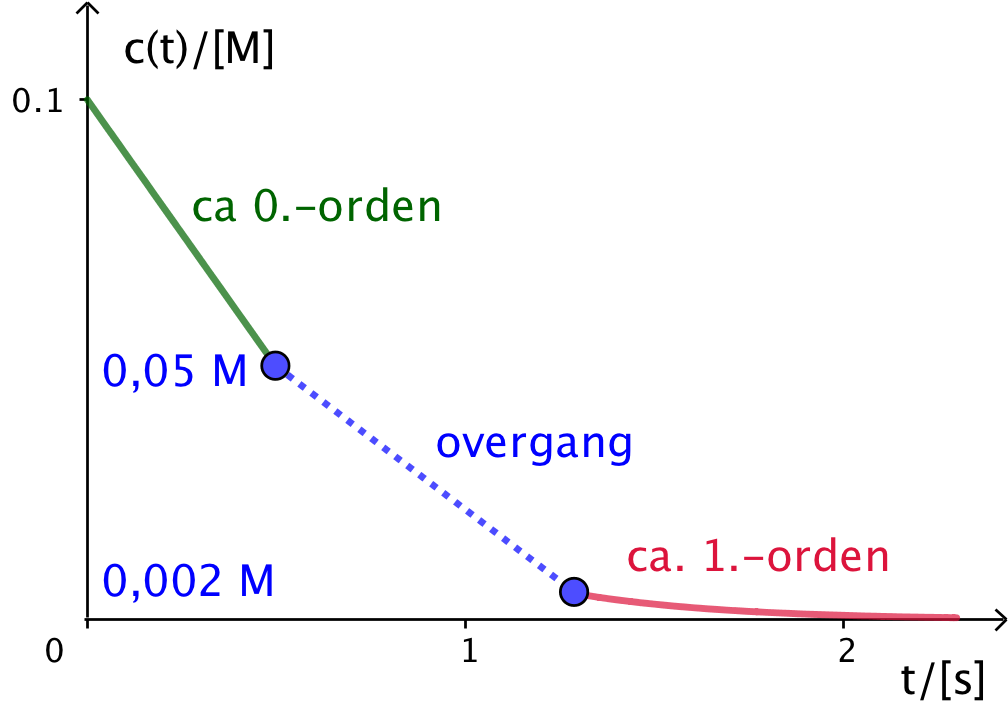
-
Volumenet findes ved at kombinere formlerne for stofmængde med pufferligningen.
Man har pufferligningen: pH = pKs + log(nB/nS). Hvor
pKs = 7,21 er minus logaritmen til syrestyrkekonstanten for H2PO4-,
nB er antal mol HPO42- og
nS er antal mol H2PO4-
Der gælder videre at: nB = nNaOH og nS = nS,start - nNaOH. Her er
nS,0 antal mol H2PO4- fra start.
Dette findes ved formlen: nS,0 = mS,0/MS, hvor
mS,0 = 340 mg er massen af KH2PO4 fra start og
MS = 136,086 g·mol-1 er molmassen af KH2PO4.
Man har nu, idet man ved at pH = 8,0 i opløsningen:
8,0 = 7,21 + log(nNaOH/((0,340g/136,086 g·mol-1) - nNaOH)).
Man har tilsidst: nNaOH = CNaOH·VNaOH = (1 M)·VNaOH, hvor VNaOH er rumfanget af tilsat NaOH-opløsning. Dette giver for VNaOH:
VNaOH = [(0,34 g)/(136,086 g·mol-1)]·[(108,0-7,21)/(1+108,0-7,21)]/(1 M) = 0,00215 L.
Dvs. man skal tilsætte 2,2 mL NaOH-opløsning for at få en pH-værdi i pufferen på 8,0.

Svar på opgave 4: Et vigtigt råstof til gummifremstilling
-
Der er tale om en eliminations-reaktion, da der der fraspaltes et mindre molekyle fra 2-chlor-2-methylpropan og dannes en dobbeltbinding.
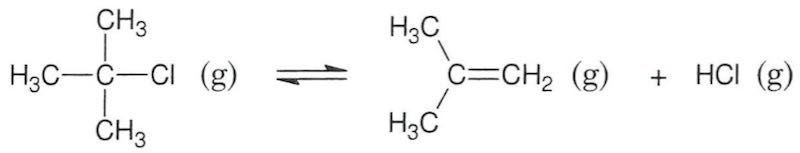
-
Man slår So op for de tre stoffer i reaktionen:
(CH3)3CCl: 322,3 J·mol-1·K-1
(CH3)2CCH2: 293,6 J·mol-1·K-1
HCl: 186,9 J·mol-1·K-1
Man finder ΔSo (ændringen i standard molær entropi) for reaktionen mod høre, ved at summere entropierne for stofferne på højre side af reaktionspilen og fratrække entropien af stoffet på venstre:
ΔSo = (293,6 + 186,9 - 322,3) J·mol-1·K-1 = 158,2 J·mol-1·K-1
Kommentar: for gasfase-reaktioner gælder, at hvis der dannes flere molekyler ved reaktionen end, der var i forvejen, så stiger entropien. Dette passer med, at ΔSo er positiv i dette tilfælde.
-
Man kender ikke totaltrykket, men det antages, at reaktionsblandingen er en ideal gas, hvorved K er uafhængig af totaltrykket.
Man skal bruge van't Hoff ligning for at finde K ved 250 °C:
ln(K) = (-ΔHo/R)·(1/T) + ΔSo/R. Her gælder, at
ΔHo er ændringen i standard molær enthalpi for reaktionen mod højre. ΔSo er den samme som før.
Man slår Ho op for de tre stoffer i reaktionen:
(CH3)3CCl: -182,2 kJ·mol-1
(CH3)2CCH2: -17,9 kJ·mol-1
HCl: -92,3 kJ·mol-1
Dette giver: ΔHo = (-17,9 + (-92,3) - (-182,2)) kJ·mol-1 = 72000 J·mol-1. Desuden har man at:
T = 273,15 + 250 K = 523,15 K og
R = 8,314 J·mol-1·K-1.
Værdierne for ΔHo, ΔSo, R og T indsættes og man får:
ln(K) = (-72000 J·mol-1)/[(8,314 J·mol-1·K-1)·(523,15 K)] + (158,2 J·mol-1·K-1)/(8,314 J·mol-1·K-1) ⇒ ln(K) = 2,4744.
Dette giver, at ligevægtskonstanten er lig med 102,4744 bar = 11,8 bar
Enheden findes fra massevirkningsloven: K = p(CH3)2CCH2·pHCl/p(CH3)3CCl, hvor K har enheden bar2/bar = bar.
-
Reaktionen forløber spontant mod højre, når ΔGo < 0. Der gælder formlen: ΔGo = ΔHo - T·ΔSo for sammenhængen mellem ΔGo og den absolutte temperatur.
Dvs. man skal løse uligheden ΔHo - T·ΔSo < 0 med hensyn til T.
Her i indsætte de værdier, der blev fundet ovenfor for temperaturen 25 °C:
72000 J·mol-1 - T·(158,2 J·mol-1·K-1) < 0 ⇒ T > (72000 J·mol-1)/(158,2 J·mol-1·K-1) ⇒
T > 455,1 K.
Dvs. temperaturen skal være over (455,1 - 273,15) °C = 182,0 °C for, at reaktionen mod højre kan forløbe spontant i standardtilstanden, dvs. ved totaltrykket 1,00 bar.
-
Man har følgende partialtryk ved ligevægt:
(CH3)3CCl ⇌ (CH3)2CCH2 + HCl
(p0 - p) p p
Her er p0 start-partialtrykket for (CH3)3CCl og p er ligevægts-partialtrykket for både (CH3)2CCH2 og HCl. Ved konstant rumfang og temperatur gælder, at partialtryk er proportionalt med stofmængde.
Dermed er (p0 - p) ligevægtstrykket af (CH3)3CCl, da ændringen i stofmængden af (CH3)3CCl er lig med den dannede stofmængde af hvert produkt. Da rumfanget er konstant er trykket af hvert stof (stoffernes partialtryk) proportional med deres stofmængde.
Man skal finde [(p0 - p)/p0]·100 %. Der gælder i følge massevirkningsloven:
p2/(p0 - p) = K. Man kender K som er 11,8 bar ved 250 °C.
Man beregner p0 ved hjælp af idealgasligningen: p0·V = n0·R·T = (m0/M)·R·T ⇒
p0 = m0·R·T/(M·V). Her er
m0 = 2,05 g lig med startmassen af (CH3)3CCl,
R = 0,08314 bar·L·mol-1·K-1 er gaskonstanten,
M = 92,57 g·mol-1 er molmassen af (CH3)3CCl,
T = (250 + 273,15) K = 523,15 K er Kelvin-temperaturen for reaktionen og
V = 2,5 L er reaktionsbeholderens rumfang.
Dette giver: p0 = (2,05 g)·(0,08314 bar·L·mol-1·K-1)·(523,15 K)/[(92,57 g·mol-1)·(2,5 L)] = 0,3853 bar.
Dette indsættes i massevirkningsudtrykket for at finde p ved ligevægt:
p2/(p0 - p) = K ⇒ p2/(0,3853 bar - p) = 11,8 bar ⇒ p = 0,3735 bar.
Den procentdel af (CH3)3CCl, der er tilbage ved ligevægt er dermed [(0,3853 bar - 0,3735 bar)/(0,3735 bar)]·100 % = 3,1 %