

Svar på opgave 1: Et aktivit stof i propolis
-
En syre ((E)-3-(3,4-diethoxyphenyl)prop-2-ensyre) reagerer med en alkohol (phenyletanol), og der dannes en ester. Dette kaldes en forestring. Hele reaktionen er vist nedenunder:
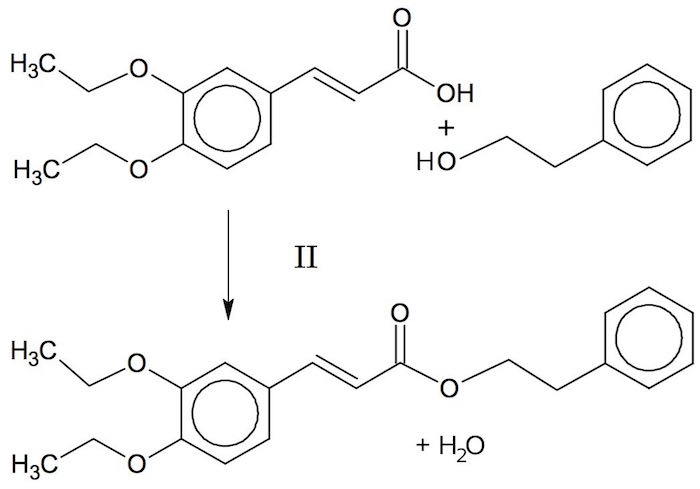
Der fraskilles desuden H2O, så er er også tale om en kondensationsreaktion.
-
Da alle stoffer reagerer 1:1, så gælder ved fuldstændig reaktion af kaffesyre, at nks = nCAPE, hvor
nks er stofmængden af kaffesyre og
nCAPE er stofmængden af CAPE.
Der gælder for stofmængden (n) af en kemisk forbindelse: n = m/M, hvor
m er masse af forbindelsen og
M er molmassen af forbindelsen.
Dvs. nks = nCAPE ⇒ mks/Mks = mCAPE/MCAPE ⇒ mCAPE = mks·(MCAPE/Mks).
Det, som man skal finde, er (mCAPE,p/mCAPE,t)·100 %, hvor
mCAPE,p er masse af CAPE i praksis (praktisk udbytte)
mCAPE,t er masse af CAPE i teorien (teoretisk udbytte).
Man har fra før, at mCAPE,t = mks·(MCAPE/Mks) = 5,00·(284,31/180,16) g = 7,89 g.
Det er oplyst, at mCAPE,p = 2,61 g. Dette giver det procentvise udbytte:
(2,61 g/7,89 g)·100 % = 33 %
-
Man slår IR-gruppefrekvenserne op i Databog Fysik-Kemi, side 56-57.
Det som adskiller stofferne er antallet af O‐H i carboxylsyre, antallet af O‐H i alkoholer og phenoler, antallet af -C‐H, antallet af =C‐H, antallet af C=C (alifatiske og aromatiske) og antallet af C‐O (i alkoholder, phenoler, ætere og estere).
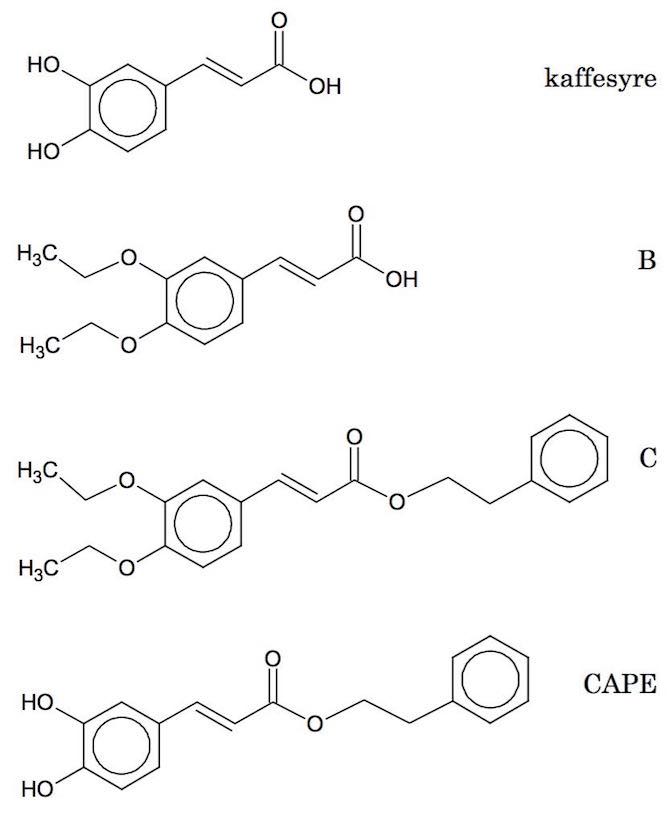
O‐H i carboxylsyre: Bred top i intervallet 3450-2500 cm-1. Kaffesyre har 1, B har 1, C har 0 og CAPE har 0.
O‐H i alkoholer og phenoler: Top i intervallet 3525-3200 cm-1. Kaffesyre har 2, B har 0, C har 0 og CAPE har 2.
-C‐H: Top i intervallet 1470-1370 cm-1 for bøjning og top omkring 3000 cm-1 for strækning. Kaffesyre har 0, B har 8, C har 14 og CAPE har 4.
=C‐H: Top i intervallet 900-625 cm-1 for bøjning ud af planen og toppe i intervallet 3000-2800 cm-1 for strækning. Kaffesyre har 5, B har 5, C har 10 og CAPE har 10.
C=C: Toppe i intervallet 1670-1450 cm-1 for strækning. Kaffesyre har 4, B har 4, C har 7 og CAPE har 7.
C‐O: Toppe i intervallet 1300-1000 cm-1 for strækning. Kaffesyre har 3, B har 5, C har 6 og CAPE har 4.
IR-spektra for kaffesyre og CAPE er vist nedenunder. Bemærk at toppene vender opad:
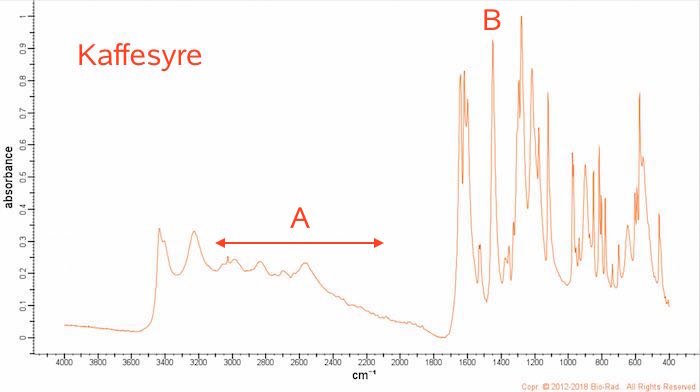
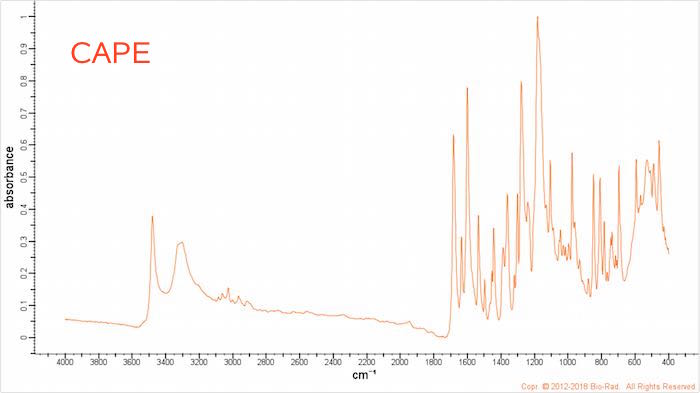
Kaffesyre har en bred top (A) i intervallet 3100-2100 cm-1 for O‐H i carboxylsyre. Denne top mangler som forventet i spektret for CAPE. Dette passer med databogen!
Noget, der ikke stemmer, er, at kaffesyre har en top ved 1450 cm-1 (B), der må stamme fra -C‐H, som kaffesyre ikke indeholder?! Yderligere mangler denne top hos CAPE, selvom denne forbindelse har -C-H bindinger!

Svar på opgave 2: Et naturmiddel mod søvnløshed
-
Omslaget på titrerkurven ligger mellem pH = 7,2 og 10,4 som vist nedenunder:
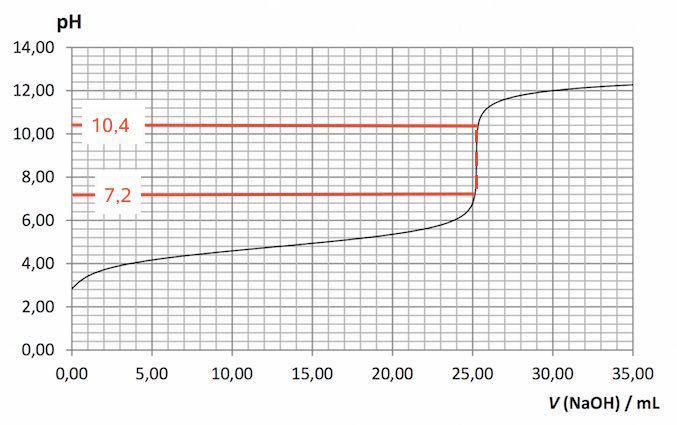
En passende indikator er derfor Fenolftalein, som har et omslag i intervallet pH = 8,3 – 10,0, der ligger indenfor kurvens omslagsområde.
-
Titreringskurvens omslagspunkt er 25,25 mL som vist nedenunder
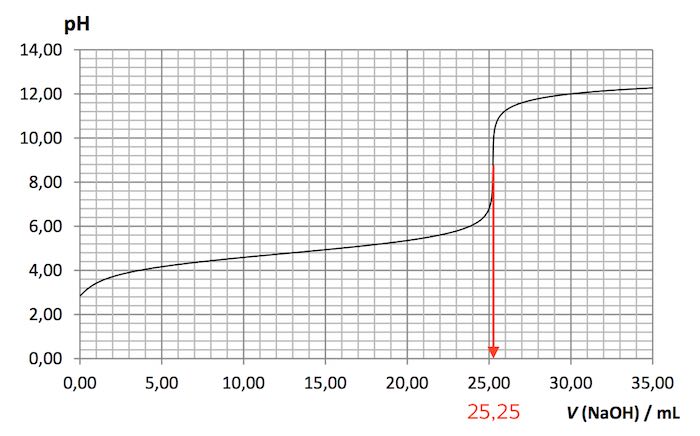
Formlen for molmasse (Ms) er Ms = ms/ns, hvor
ms er massen af syre og
ns er den formelle stofmængde af syre.
Ved omslag gælder desuden, at ns = nNaOH = CNaOH·VNaOH. Her er
CNaOH er koncentrationen af NaOH-opløsning og
VNaOH er volumenet af tilsat NaOH-opløsning.
Man får i alt: Ms = ms/(CNaOH·VNaOH) = (0,254 g)/[(0,0986 mol/L)·(0,02525 L)] = 102,0 g/mol
Dvs. syrens molmasse er 102 g/mol
-
Syrens pKs-værdi aflæses til 4,8. Dette er vist nedenunder.
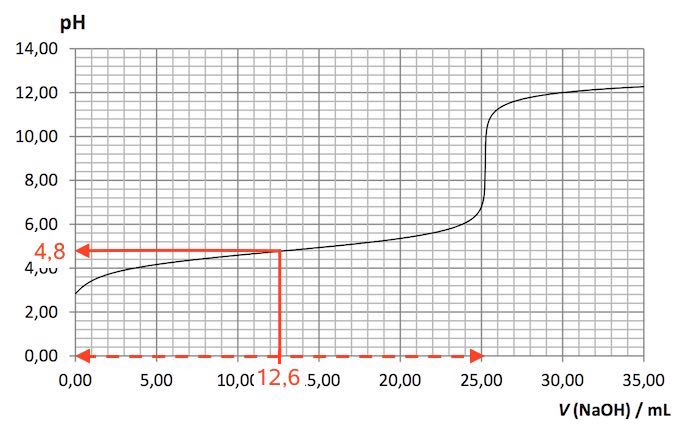
Man skal finde [B]/([S] + [B]) = ([B]/[S])/(1 + [B]/[S]) = x/(1+x), der er den del af syren, der er omdannet til base, og hvor
[B] er den aktuelle koncentration af korresponderende base til syren,
[S] er den aktuelle koncentration af syren og
x er [B]/[S].
Ved hjælp af pufferligningen finder man x: solve(4.5=4.8+log(x,10),x) ▸ x=0.501187
Dette bruges til at beregne, hvor stor en andel af syren, som er omdannet til base: 0,5012/(1 + 0,5012) = 0,334
Dvs. 33 % af syren er omdannet til dens korresponderende base i urin ved pH = 4,5.
-
Esteren er sammensat af en syre med molekyleformlen C5H10O2 og ethanol (C2H5O). Esteren har selv molekyleformlen C7H14O2 fordi H2O splates fra under dens dannelse.
Nedenfor er vist stregformler for to af de mulige estre:
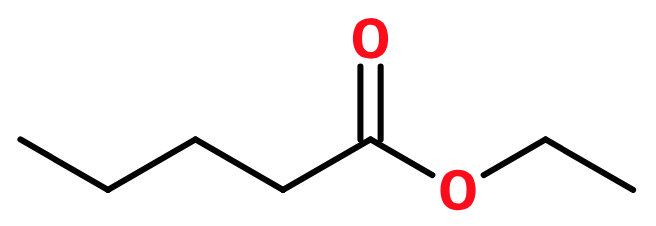
ethylpentanoat og
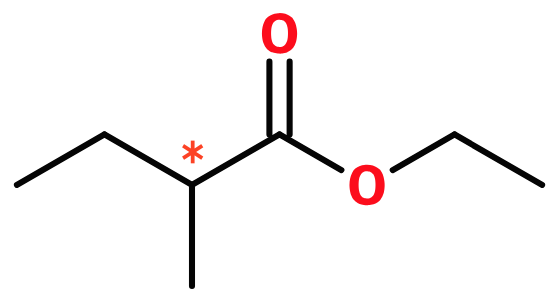
ethyl 2-methylbuthanoat.
Stjernen i stregformlen markerer det asymmetriske carbon atom i den sidste ester. Det er denne ester, der udviser stereoisomeri.
-
Man har i alt følgende fire muligheder for esteren:
CH3[CH2]3COOCH2CH3 (ethylpentanoat)
CH3CH(CH3)CH2COOCH2CH3 (ethyl 3-methylbutanoat)
CH3CH2CH(CH3)COOCH2CH3 (ethyl 2-methylbutanoat)
CH3C(CH3)2COOCH2CH3 (ethyl 2,2-dimethylpropanoat)
På billedet nedenunder er kemisk skift vist med blåt, integrale med rødt og split (kobling) med grønt for hver af de 5 toppe i NMR-spektret.
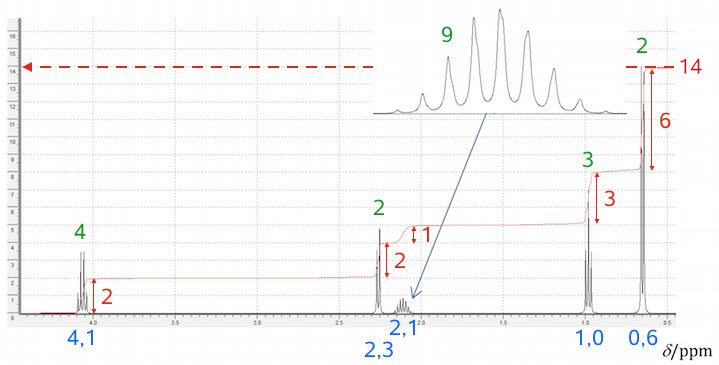
Grønne tal: 2 = dublet, 3 = triplet, 4 = kvartet og 9 = nonet.
Det fremgår, at integralet af toppene er 14, som er lig med antallet af H i stoffets bruttoformel. Dermed er integralet for en top og antallet af H, der indgår i toppen, det samme.
Et integrale på 6 (yderst til højre) viser, at der er to endestillede CH3-grupper, som sidder på samme C-atom, hvilket gør at deres H'er giver en samlet top. Det at denne top er en dublet viser, at der er 1 H på deres fæles nabo C-atom.
Dermed kan der kun være tale om ethyl 3-methylbutanoat
Kommentar:
Når man analyserer et NMR-spektrum, så vil man starte med at se efter toppe med højt kemisk skift, stort split (mange undertoppe) eller stort integrale.
I dette tilfælde er toppen med det højeste kemiske skift ens for alle fire muligheder, så den kan ikke bruges til at skille nogen ud. Et split med mange små toppe tyder på et H, der sider ved en forgrening. En top med lavt skemisk skift er typisk CH3 for enden af en kulstofkæde. Et integrale på 6 tyder på to CH3 der danner en forgrening for enden af en kulstofkæde.
(Et integrale på 4 eller 5 tyder på, at H'erne sidder i en benzenring. Det samme gør et skift på 7-8.)
Nedenunder er de enkelte toppe for ethyl 3-methylbutanoat forklaret på NMR-spektret.
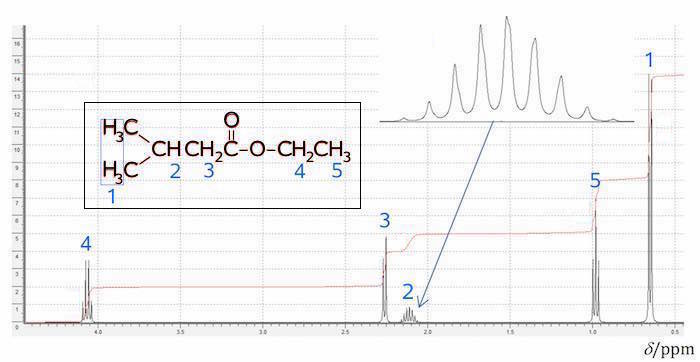
Blå tal viser, hvilke H'er i strukturformlen, der svarer til hvilke toppe i NMR-spektret.
Toppen længst til venstre (mærket 4) stammer fra -O-CH2CH3. Det er en kvartet med integralet er 2. Denne top har det højeste kemisk skift, hvilket passer med at dets H'er deshieldes af O. Integralet på 2 passer med, at det er en CH2-gruppe. Det at toppen er en kvartet passer med, at nabo C'et har 3 H.
Toppen mærket 3 stammer fra -CH2-C(=O)-O- har det næsthøjeste kemiske skift, hvilket passer med, at dets 2 H'er sidder på et C, der er nabo til C=O. Dette O giver H'erne en forholdsvis høj deshielding.
Toppen mærket 2 stammer fra CH3-CH(-CH3)-CH2-. Den har integralet 1 og stammer derfor fra et H. Det er en nonet, hvilket passer med, at nabo C'erne tilsammen har 8 H.
Toppen mærket 5 stammer fra -CH2CH3-. Det er en triplet med integralet 3 og har et lavt kemisk skift. Dette passer med at nabo C'et har to H, at der indgår 3 H'er i gruppen og at H'erne er langt fra O'erne.
Toppen mærket 1 stammer som nævnt fra CH3-CH(-CH3)-.
Toppene 2 og 3 er en smule skæve, hvilket skyldes at de ligger tæt på hinanden.

Svar på opgave 3: D3-vitamin
-
På figuren nedenunder er hvert C markeret med et tal, der viser hvor mange H'er, der sidder på C'et. Dvs. antal tal er lig med antal C-atomer og summen af tallene plus 1 (for OH) er lig med antallet af H-atomer.
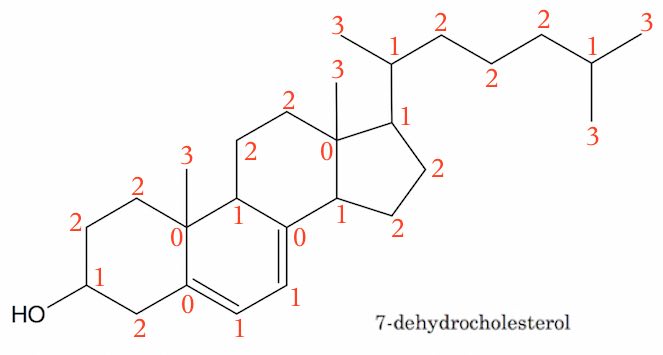
Antallet af tal er 27. Summen er 43 hvortil lægges 1, så man får 44 H-atomer. Molekylet indeholder desuden 1 O-atom.
Molekyleformlen bliver dermed C27H44O
-
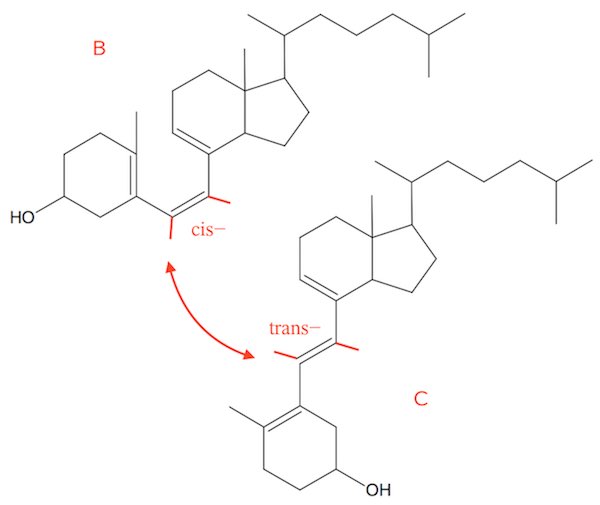
Stofferne B og C er hinandens stereoisomerer.
Den ene er en cis- og den anden en trans-forbindelse. Dette er vist på figuren nedenunder, hvor de røde streger ved dobbeltbindingen står for H-atomer.
-
Der ses bort fra højere reaktionsordner end 2.
En 0.-te ordens reaktion har den generelle formel: CA(t) = a·t + b
En 1.-te ordens reaktion har den generelle formel: CA(t) = exp(a·t + b)
En 2.-te ordens reaktion har den generelle formel: CA(t) = 1/(a·t + b)
Her står t for tiden, CA(t) er ændringen i koncentrationen af A som funktion af tiden, mens a og b er konstanter .
I Ti-Nspire oprettes en liste med tiderne.
tid:={13,20,26,41,55,69,84,97,112} ▸ {13,20,26,41,55,69,84,97,112}
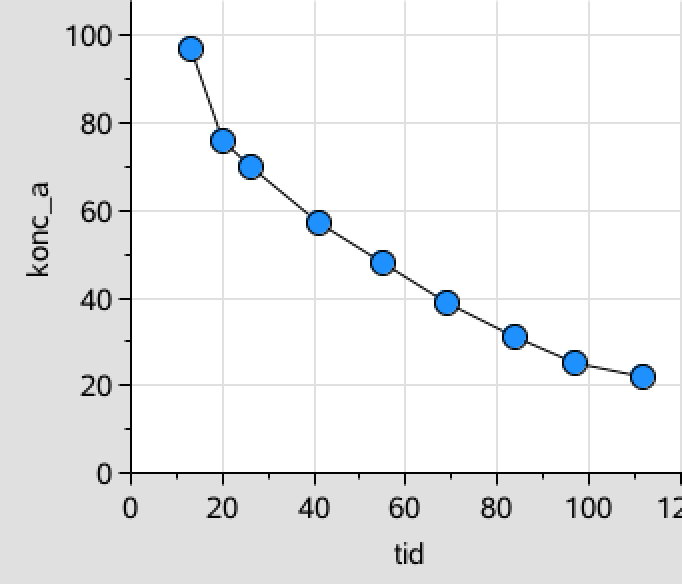
For at teste for 0.-orden oprettes en liste med koncentrationen af A og denne afbildes som funktion af tiden:
konc_a:={97,76,70,57,48,39,31,25,22} ▸ {97,76,70,57,48,39,31,25,22}
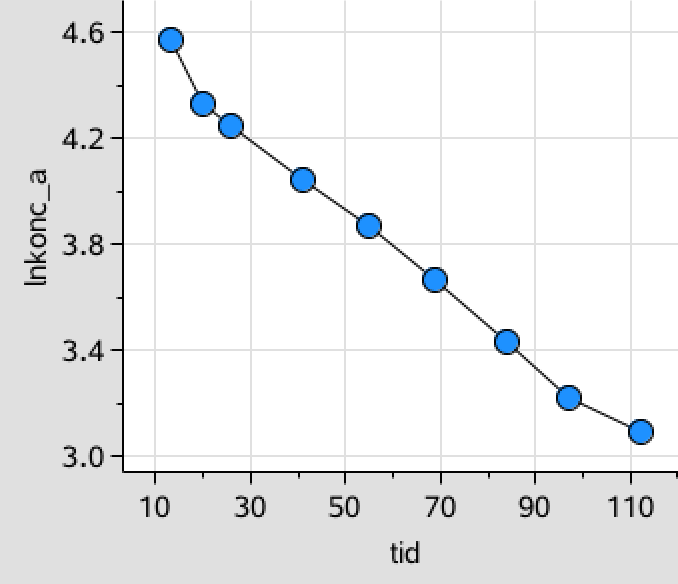
For at teste for 1.-orden oprettes tilsvarende en liste med den naturlige logaritme til koncentrationen af A, der også afbildes som funktion af tiden:
lnkonc_a:=1.*ln(konc_a) ▸ {4.575,4.331,4.25,4.043,3.871,3.664,3.434,3.219,3.091}
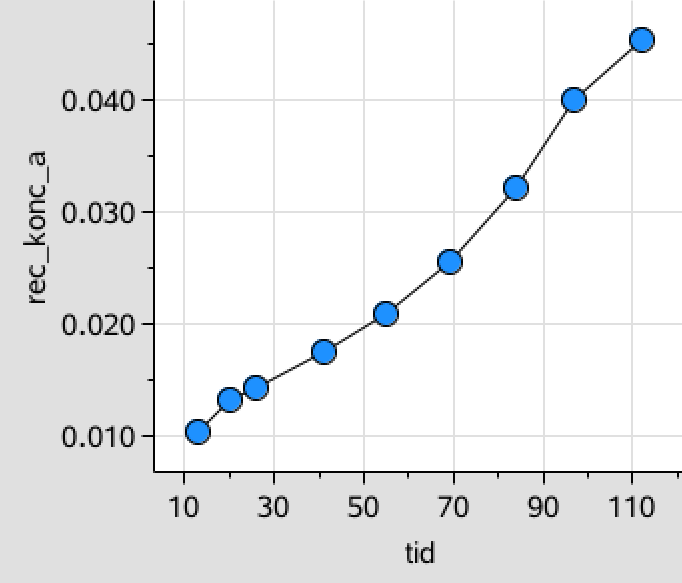
For at teste for 2.orden oprettes endelig en liste med den reciprokke til koncentrationen af A og denne afbildes som funktion af tiden:
rec_konc_a:=1./konc_a ▸ {0.0103,0.0132,0.0143,0.0175,0.0208,0.0256,0.0323,0.040,0.0455}
Den kurve, der er tættest på en ret linje, er den der bedst passer til den reaktionsorden, som den tester for.
I dette tilfælde er det ikke helt tydligt, hvilken som passer bedst, men ved at lave en lineær regression for de tre lister med koncentration som funktion af tiden, så ses det, at 1.-orden passer bedst (r2 = 0,99).
Dvs. reaktionen er af 1. orden
-
En organisk forbindelse regnes for vandopløseligt, hvis den har en hydrofil gruppe eller flere for hver 4 C-atomer i forbindelsen. Hvis det har færre, så er det fedtopløseligt. På nedenstående figurer er hydrofile grupper indrammet med rødt.
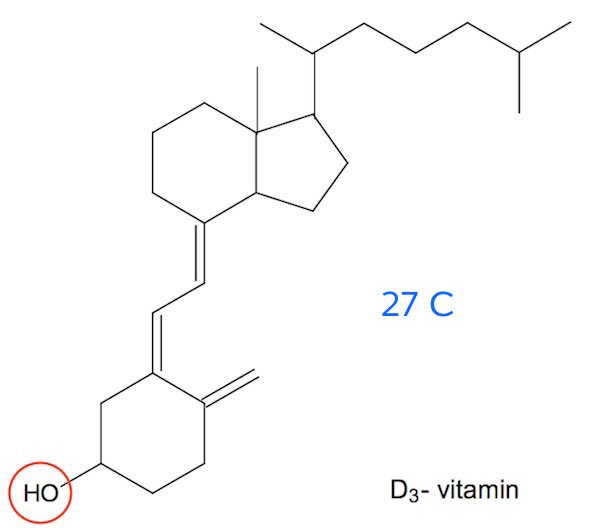
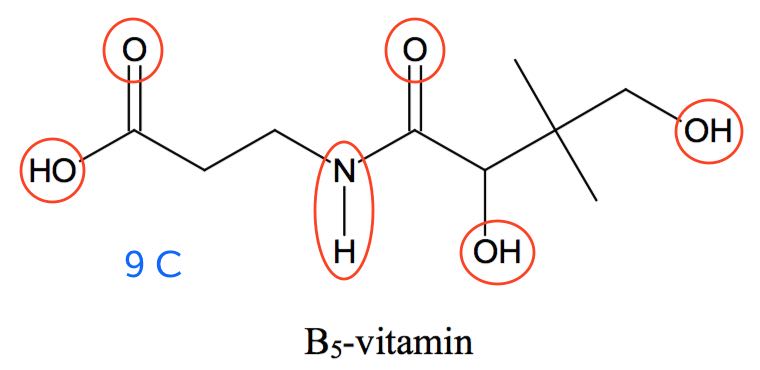
Det fremgår det, at D3-vitamin en hydrofil gruppe og 27 C-atomer, mens B5-vitamin har 6 hydrofile grupper og 9 C-atomer.
Dermed er D3-vitamin fedtopløseligt, mens B5-vitamin er vandopløseligt

Svar på opgave 4: Blyhvidt
-
Reaktionsbrøken er Y = pCO2·pH2O/pH2S, hvor
pCO2 er partialtrykket i bar af CO2,
pH2O er partialtrykket i bar af H2O og
pH2S er partialtrykket i bar af H2S.
Man medtager kun gasser i reaktionsbrøken og ikke faste stoffer.
-
Ændringen i standard molær entropi for reaktionen mod højre, ΔSo, er lig med summen af standard molære dannelsesentropier for produkter minus summen af standard molære dannelsesentropier for reaktanter.
Dette giver: ΔSo = (91,2 + 213,8 + 188,8 - (131,0 + 205,8)) J·mol-1·K-1 = 157,0 J·mol-1·K-1
-
Man skal bruge formlen: ΔGo(18 °C) = ΔHo(25 °C) - T·ΔSo(25 °C), hvor
ΔGo(18 °C) er reaktionens molære standard Gibbs' fri energi ved 18 °C,
ΔHo(25 °C) er reaktionens molære standard enthalpi ved 25 °C og
ΔSo(25 °C) er reaktionens molære standard entropi ved 25 °C.
Det antages, at ΔHo og ΔSo ikke ændres med temperaturen, og man derfor kan bruge værdierne for 25 °C.
Man beregner først ΔHo(25 °C) ved hjælp af tabelværdier:
(−100,4 - 393,51 - 241,8 - (−699,5 - 20,63)) kJ·mol-1 = −15,58 kJ·mol-1
Dette indsættes i formlen sammen med ΔSo(25 °C) fra sidste spørgsmål:
ΔGo(18 °C) = (−15,58 - (273,15 + 18)·157,0·10-3) kJ·mol-1 = −61,3 kJ·mol-1
-
Ved ligevægt er Gibbs frie energi (ΔG) lig med 0 for en reaktion.
For at finde partialtrykket af H2S ved ligevægt, så skal man bruge formlen
ΔG = ΔGo(18 °C) + R·T·ln(Y), der ved ligevægt giver
ΔGo(18 °C) + R·T·ln(Y) = 0.
Man indsætter partialtrykkene for CO2 og H2O i Y fra spørgsmål a). Man løser derefter den fremkomne ligning med hensyn til pH2S (p):
solve(0=−61.3*103+8.314*(273.15+18)*ln(4.*2.6*10-7/p),p) ▸ p=1.051·10−17 (Ti-Nspire)
Dvs. ved ligevægt ved 18 °C er partialtrykket af H2S lig med 1,05·10−17 bar
Når partialtrykket af H2S er over 1,05·10−17 bar, vil reaktionen forløbe spontant mod højre, eftersom ΔG derved er negativ. Dette gælder ved 18 °C og 1 bars totaltryk. Da det normale partialtryk af H2S er ca. en nanobar (som nævnt i opgaven), så vil maleriet hele tiden farves mørkere.